بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
مقدمه:
تجزیه و تحلیل حالتهای اتمی با چندین الکترون کار پیچیده ای است.
بر همکنش ها موجود:
بین الکترونها و هسته ، بین تک تک الکترونها با یکدیگر ، بین اندازه حرکت مداری و اسپینی الکترون ،
بر همکنش اسپینی بین الکترونهای مختلف.
اسلاید 2 :
3-1 برهمکنشهای الکتروستاتيک و جفت شدگی L.S
الف) کوپل شدگی L.S به پيشنهاد راسل و ساندرز
مثلا” برای يک اتم دو الکترونی
توجه: برای مقدار واقعی اندازه حرکت زاويه ای مداری و L مربوطه ، نياز به دو يا چند
الکترون ونيز مولفه های L بر روی محور Z خواهيم داشت .
اسلاید 3 :
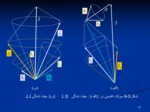
شکل 3-1 مدل برداری عدد کوانتمی L برای دو الکترون
ب ) جفت شدگی L و (L.S Coupling) S
اگر اتمی دو الکترون در قشر خارجی اش داشته باشد اسپين کل بشرح زير کوانتيزه می باشد:
اسلاید 4 :
شکل 3-2 نمايش مولفه های Z
(الف) برداراندازه حرکت زاويه ای اربيتالی ،
(ب) برداراسپينی که S آن عددی نيمه صحيح و(ج) بردار اسپينی که S آن عددی صحيح است.
اسلاید 5 :
ج) اندازه حرکت کل اتم:
در مدل L.S Coupling برهمکنش قوی بين l ها و نيزبين خود Sها وجود دارد ولذا برای اندازه حرکت کل اتم بر همکنش ضعيف بين l ها و sها باعث جمع کل آندو برای اتم بصورت J=L+S می شود . مشابه توضيحات قبلی داريم:
برای الکترون، حالتهای مختلف که بيانگر
وضعيت ترازهای انرژی است. بصورت زير است:
در حاليکه برای سطوح انرژی اتمها داريم:
اسلاید 6 :
بطور کلی برای هر حالت اتمی خاص علامت حالت چنين نوشته می شود:
که 2S+1 چندگانگی حالت اتمی ، L حالت اتمی و انديس J عدد کوانتمی
اندازه حرکت زاويه ای کل است.
مثال 1: براي S=3/2 و L=2 چندگانگي راهمراه بامحاسبه مقادير J نشان دهيد . حالات اتمي كدام است ؟
مثال 2: درمثال1 ،اگر=1 L باشد ،نتيجه چه خواهدبود ؟ همچنين حالتهاي اتمي رادراين مثال نشان دهيد .
توجه:
اگر L>S باشد ، چندگانگی 2S+1 می باشد و تعداد واقعی ترازها با J های متفاوت درست برابر با چندگانگی خواهد بود .
و اگر L<S باشد ، چندگانگی همان 2S+1 ميباشد، ولی اين بار فقط مقدار2L+1 برای J خواهيم داشت.
اسلاید 7 :
ضمنا” چندگانگی لايه های انرژی را با توجه به مقادير مختلف آ ن بصورت زير نامگذاری ميکنند.
چنانچه اتمی تحریک شده و الکترونهای ان از حالت پایه به حالت انرژیهای بالاتر منتقل شده باشد در
بر گشت به حالت پایه تشعشع خواهند داشت.
برای تشعشع های با شدت بالا قوانين انتخاب را يکبار ديگر، پس از بحث روش L.S Coupling در اينجا مورد
باز بينی قرار می دهيم.
استثناء زما ن است که فقط يک الکترون داشته باشيم ( در اينصورت )
اسلاید 8 :
مثال 3: حداكثرتعداد الكترونهايي كه مي تواند در زيرلايه d جاي گيرد، چقدراست ؟
مثال 4: نشان دهيد كه دراتمي شامل زيرلايه هايي پرازالكترونهاي مجاز، حالت پايه عبارتست از، حالت S
مثال 5: گسيلهايی که بين لايه های D و F با برهمکنش L.S می توانند انجام شوند،کدامند ؟
مثال 6: فرض كنيد طيف اتم Li ،همانند طيف اتم هيدروژن مي باشد . انرژي يونيزاسيون آن
را حساب كنيد،اگر انرژي يونيزاسيون تجربي آن 39/5 الكترون ولت باشد، چه تعبيري براي
اختلاف نتيجه تجربي و نتيجه محاسبه شده انرژي فوق مي توان داشت ؟
اسلاید 9 :
3-2 جفت شدگی J.J
در اين جفت شدگی، برهمکنش L.S هرالکترون، قويتر از ساير برهمکنشها می باشد،
لذا ابتدا s و l هرالکترون باهم کوپل شده وبردار جديد j را که برابر با j=l+s است
تشکيل می دهند ، سپس j هر الکترون با الکترون ديگر برهمکنش می کند.
اگر اتم با یک الکترون ظرفیتی باشد اندازه حرکت کلی
برای دو مقدار انرژی ، مربوطبه دو مقدار ممکن j بدست می آيد که اين ،
خود دليل ساختار دوگانه بودن طيف اتمها با يک الکترون ظرفيتی،مانند فلزات قليايی را آشکار می کند.
شکل 3-7 مدل برداری برای عدد کوانتمی j
اسلاید 10 :
جفت شدگی l و s به روش J.J باعث می شود که اعداد کوانتمی m و m معنای
خود را از دست داده ودر حقيقت m را موثر بدانيم چرا که l و s بايد در حال انجام حرکت
تقديمی حول برآيندشان، يعنی j (نه حول محور Z) وتصاوير آن همان m در نظر گرفته شوند.
ترازها با j معين دارای تبهگنی 2j+1
تراز هم انرژی است که از مقادير ممکن
از (+j تا -j ) بوجود می آيند واين تبهگنی توسط
يک ميدان مغناطيسی خارجی می تواند از بين رود.