بخشی از مقاله
مقدمه
1-1- مقدمه:
كشور ايران يكي از غنيترين كشورهاي جهان از نظر ذخاير گاز طبيعي است. با برخورداري از چنين ذخيرهاي، گاز به عنوان سوخت و انرژي ميتواند در صدر منابع مورد استفاده قرار گيرد تا پاسخگوي رشد روزافزون مصرف انرژي و همچنين منبعي براي درآمدهاي حاصل از صادرات تلقي گردد. گاز آن طور كه در طبيعت موجود است كمتر مورد استفاده قرار ميگيرد، زيرا گازي كه از منابع نفتي حاصل ميشود، داراي مقادير متفاوتي هيدروژن سولفوره (H2S) و دياكسيدكربن (CO2) به عنوان ناخالصي ميباشد و اصطلاحاً گاز ترش ناميده ميشود.
گرچه مقدار زياد CO2 به علت نداشتن ارزش حرارتي، مطلوب نيست ولي (H2S) بااهميتترين ناخالصي در گاز است كه بايد آنرا تفكيك نمود. در واقع به علت سمي بودن زياد، (H2S) قابل مقايسه با سيانيد هيدروژن (HCN) بوده و بايستي از گاز تصفيه شود.
از مهمترين دلايل لازم براي جداسازي تركيبات حاوي CO2 و SO2 ميتوان به موارد زير اشاره نمود:
- خوردگي تركيبات اسيدي
- آلودگي محيط زيست بوسيله تركيبات گوگرددار.
- منجمدشدن دياكسيدكربن در فرآيندهاي سرمايشي به منظور بازيافت محصول مايع (NGL)
- تأثيرات نامطلوب اين تركيبات بر كاتاليزورهاي صنايع پالايشي پاييندستي.
براي تصفيه گاز متداولترين روشي كه در ايران مورد استفاده قرار ميگيرد، روش جذب برگشتپذير در فاز مايع است.
2-1- بررسي كلي فرآيندهاي شيرينسازي گاز ترش:
الف- فرآيندهاي جذبي فيزيكي توسط حلال:
فرآيند جذب فيزيكي عبارت است از مجاورنمودن مخلوط گاز با يك حلال مايع كه در اثر انتقال جرم، بعضي از اجزاي مخلوط گازي وارد حلال مايع شده و بدين وسيله جداسازي صورت ميگيرد. از مهمترين فرآيندهاي جذب فيزيكي با حلال ميتوان به فرآيندهاي Selexol و Flour Solvent اشاره كرد.
ب- فرآيندهاي جذب سطحي
در جذب سطحي اجزاي مشخصي از مخلوط گازي روي سطح فعال يك ماده جاذب جذب ميشود. كاربرد اين روش در شرايط خاص ميباشد، مثلاً در مواردي كه جداسازي تا حد بسيار دقيق و كامل مورد نظر باشد، ميتوان از سيليكاژل، زئوليتها و يا غربالهاي مولكولي استفاده كرد.
ج- فرآيندهاي شيميايي:
اين روش در حذف CO2 و H2S از گاز طبيعي، كاربرد وسيعي دارد. اين روش براساس واكنش شيميايي برگشتپذير بين H2S يا CO2 و يك محلول بازي ضعيف قرار دارد كه نمك حاصل شده در اثر حرارت به مواد اوليه تجزيه ميگردد.
در حال حاضر آلكانول آمينها كه عمدتاً به عنوان آمين شناخته شدهاند، به طور گستردهاي در صنايع پالايش گاز به عنوان حلال براي جذب هيدروژن سولفوره و دياكسيدكربن مورد استفاده قرار ميگيرند. واكنش آمينها با گازهاي اسيدي يك واكنش برگشتپذير ميباشد كه در واكنش رفت (برج جذب) گازهاي اسيدي و آمين واكنش از نوع اسيد و باز را در فشار بالا انجام ميدهند و نمك آمين بوجود آمده به كمك حرارت در فشار پايين واكنش برگشت را براي بازيابي آمين و گازهاي اسيدي انجام ميدهند.
معموليترين آميني كه تاكنون مورد استفاده قرار گرفته، مونو اتانل آمين (MEA) است كه در بين آمينهاي گوناگون قويترين باز بوده و به آساني با H2S و CO2 به صورت غيرانتخابي تركيب ميشود. مونواتانل آمين (MEA) داراي پائينترين مقدار وزن مولكولي بوده و بر پاية وزن يا حجم بالاترين پتانسيل جداسازي را دارا ميباشد. فراتر از آن از نظر شيميايي پايدار است و به آساني مورد بازيابي قرار ميگيرد،
ناگفته نماند كه واكنش آن با CS2 و COS به صورت غيربرگشتي بوده كه منجر به از دست رفتن محلول شده و باعث شكلگيري جامدات در محلول ميشود. اگرچه MEA از بسياري جهات آمين مناسبي است و در حقيقت بسياري از اشكالات سيستمهاي آمين در اين واحدها مورد مطالعه قرار ميگيرند اما توسعه فرآيندهاي خاص بر پاية آمينهاي ديگر در افزايش ظرفيتهاي جداسازي و گزينشپذيري (Selectivity) براي H2S و سرانجام كاهش انرژي مورد نياز براي بازيابي مورد توجه قرار گرفته است. آمينهايي كه به اين ترتيب مورد استفاده قرار ميگيرند عبارتند از
- دي اتانل آمين (DEA)
- تري اتانل آمين (TEA)
- ديايزوپروپانل آمين (DIPA)
- متيل دي اتانل آمين (MDEA)
- دي گلايكول آمين (DGA)
دي اتانل آمين، آمين نوع دومي است كه خاصيت بازي ضعيفتري نسبت به مونو اتانل آمين دارد، در نتيجه به حرارت كمتري در واكنش بازيابي نياز دارد. از نظر وزني DEA نسبت به MEA داراي بازدهي كمتري است و بنابراين موجب بالارفتن شدت جريان و يا غلظت ميگردد. از خصوصيات ديگر DEA اينست كه نسبت به MEA گزينشپذيري بيشتري براي جذب H2S دارد و با COS و CS2 واكنش نميدهد.
دياتانل آمين يكي از معموليترين آمينهايي است كه واحدهاي گاز براي جذب و جداسازي گازهاي اسيدي بكار ميرود.
لازم به ذكر است كه ميتوان دو يا چند آمين متفاوت به همراه حلالهاي فيزيكي را بكار برد تا شرايط بهينهاي را براي يك فرآيند بوجود آورد.
فصل دوم:
پالايش گاز طبيعي
1-2- مروري بر روشهاي تصفيه گاز:
قبل از پيدايش روشهاي متداول براي حذف H2S و CO2 از گاز طبيعي، از آهك استفاده ميشد و آهك مصرف شده دور ريخته ميشد.
در سال 1910 روش اكسيدآهن ابتدا در انگلستان و سپس در ساير نقاط رواج يافت و در سال 1920 روش كربنات پتاسيم Sea Board بوسيلة كمپاني KOPPER معرفي گرديد در واقع اين اولين روش تجارتي بود كه گازهاي اسيدي توسط مايع شستشو داده ميشد. روش استفاده از آمين در سال 1930 به ثبت رسيد و در سال 1939 روش مخلوط آمين و گلايكول پيشنهاد شد كه پالايش و خشك كردن گاز را به صورت همزمان انجام ميداد.
در سال 1948 تجارتي كردن اين روشها به تفصيل مورد بررسي قرار گرفت. روشهاي جذب سولفينول در سال 1965 بوجود آمد و روش فلور و استفاده از غربالهاي مولكولي به تدريج جانشين روشهاي قديمي گرديد.
به طور كلي روشهاي پالايش گاز در چهار گروه به صورت زير طبقهبندي ميگردند:
1- روش شيميايي مثل استفاده از آمينها، مخلوط گلايكول و آمين و كربنات پتاسيم.
2- استفاده از حلالهاي فيزيكي مثل پروپيلن (فلور) – ديمتيل اتر (SELEXOL) و تتراهيدروتيوفن دياكسيد (Solfinol).
3- روش اكسيدكردن گاز
4- روش جذب سطحي مانند استفاده از غربالهاي مولكولي
انتخاب هر يك از روشهاي فوق به عوامل متعددي نظير فشار در مرحلة عمليات، درجة حرارت گاز مورد پالايش، نقطة جوش حلال، گرماي حاصل از فعل و انفعالات در برج جذب، غلظت مادة مصرفي، مقايسه اقتصادي ميزان انرژي مصرفي و سرويسهاي جانبي بستگي دارد.
در روشهاي فوق عامل جذب گازهاي اسيدي اعم از فيزيكي يا شيميايي را ميتوان دوباره احياء نمود. روشهاي ديگري نيز وجود دارند كه ميتوان حداكثر گازهاي اسيدي را جذب نمود اما در آنها ماده شيميايي مصرف شده ديگر قابل احياء نيست. اين روشها مقرون به صرفه نيستند و در مواردي كه مقدار گاز اسيدي بسيار كم باشد، مورد استفاده قرار ميگيرند.
به طور خلاصه ميتوان گفت كه براي انتخاب فرآيندهاي مناسب و اقتصادي، مشخصات استاندارد گاز براي فروش، مشخصات گاز خوراك ورودي، شرايط فرآيندي يا عملياتي و محل جغرافيايي تأسيسات را به عنوان عوامل مؤثر ميتوان در نظر گرفت.
2-2- كيفيت استاندارد گاز شيرين:
كيفيت استاندارد براي گازهاي تصفيه شده معمولاً جداسازي تركيبات گوگرد و گاز كربنيك را به شرح زير توصيه مينمايد.
هيدروژن سولفوره:
مطابق استانداردهاي صنعت گاز حداكثر برابر با يك چهارم گرين (Grain) در يكصد فوت مكعب گاز ميباشد. واحد گرين برابر پوند ميباشد.
مقدار يك چهارم گرين در يكصد فوت مكعب استاندارد (SCF) حدود مول H2S در بردارد كه اين مقدار معادل با 4 P.P.m حجمي ميباشد. مقدار وزني H2S در گاز بستگي به چگالي دارد. براي گاز طبيعي ترش با چگالي 0.65 مقدار H2S در گازهاي شيرين استاندارد برابر 7P.P.m وزني ميباشد.
در سيستم متريك در گاز با يك چهارم گرين H2S حدود 6 ميليگرم H2S در هر متر مكعب گاز وجود دارد. در فشار 1000Psi فشار جزئي H2S در گاز با يك چهارم گرين H2S برابر با 0.2 mmHg ميباشد.
مركاپتان: كمتر از يكچهارم گرين در يكصد فوت مكعب گاز.
كل مشتقات گوگردي: كمتر از پنج گرين در يكصد فوت مكعب گاز.
گاز كربنيك: تا مقدار 0.2 مولي (حجمي) در گاز طبيعي و كمتر از 500 P.P.m تا 1000PPm براي تغذيه كارخانجات پتروشيمي.
سقف تعيين شده براي موجودي گوگرد در گاز شيرين در استانداردهاي بينالمللي عبارت است از:
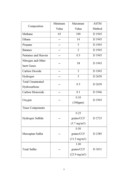
الف- در استاندارد ASTM كيفيت گازهاي طبيعي در خطوط لوله طبق جدول صفحة بعد اعلام شده است. (جدول 1-2)
ASTM
Method Maximum
Value Minimum
Value Composition
D 1945 100 65 Methane
D 1945 14 -- Ethane
D 1945 5 -- Propane
D 1945 2 -- Butanes
D 1945 0.5 -- Pentanes and Heavier
D 1945 18 -- Nitrogen and Other Inert Gases
D 1945 3 -- Carbon Dioxide
D 2650 5 -- Hydrogen
D 2650 0.5 -- Total Unsaturated Hydrocarbons
D 1946 0.1 -- Carbon Monoxide
D 1945 0.10 (100ppm) -- Oxygen
Trace Components
D 2725 0.25 grains/CCF (5.7 mg/m3) -- Hydrogen Sulfide
D 2385 0.50 grains/CCF (11.5 mg/m3) -- Mercaptan Sulfur
D 3031 1.00 grains/CCF (22.9 mg/m3) -- Total Sulfur
D 1142 7.0 pounds/MM (110mg/m3) -- Water Vapor
جدول 1-2- استاندارد كيفيت گاز طبيعي در خطوط لوله
ب- در استاندارد NACE (1948)، حداكثر مقدار فشار جزئي 0.05 Psi در گاز با فشار كل 3600 Psi كه معادل 14 ppm حجمي خواهد بود براي جلوگيري از پديدة Stress Corrosion Cracking براي گاز هيدروژن سولفوره تعيين و اعلام شده است.
ج. در امريكا، گاز شيرين به گازي گفته ميشود ه در هر يكصد فوت مكعب مكعب استاندارد (SCF) از آن گاز، بيش از يك چهارم گرين گاز H2S وجود نداشته باشد.
3-2- عوامل مؤثر بر انتخاب فرآيند شيرينسازي:
تصفيه گاز شامل جداسازي ناخالصيهاي اسيدي مانند H2S، CO2، SO2 و تركيبات آلي گوگرد و ناحالصيهاي ديگر ميباشد. ناخالصيها به منظور جلوگيري از خوردگي، بسته شدن و بلوكه شدن جريان گاز و سمي بودن آنها، بايستي از جريان گاز طبيعي به وسيلة روشهاي مختلف، جدا گردند.
فرآيند بايد به گونهاي باشد كه به حد نشانة خلوص (Clean Up Target) برسيم.
اين فاكتور براي فرآيندهاي مختلف، متفاوت ميباشد. مثلاً در مورد گاز طبيعي، حد مطلوب كمتر از 4ppm براي H2S و كمتر از يك درصد گاز CO2 در خروجي است. در حالي كه براي واحد آمونياك و واحد LNG مقدار CO2 در حد 100ppm مطلوب است.
حد نشانه خلوص نقش مهمي در انتخاب فرآيند شيرينسازي ايفا ميكند كه در جدول (2-2) آورده شده است.
Common Cleanup targets (% acid gas) Acid gases to treating Process
<0.1% CO2
10ppm H2S CO2
Co2 + H2S + COS Hydrogen manufacture
Petroleum desulfurization
Coal liquefaction
Chemicals
<16ppmCO2 + CO
0.01ppmH2S CO2
Co2 + H2S + COS Ammonia manufacture
(H2/N2 mixture)
Natural gas purification
<4ppmH2S; <1%CO2
1-2ppmH2S; <50ppmCO2
<500ppm CO2;<0.01ppmH2S
H2S, CO2, COS, RSH, etc. Natural gas purification
Pipeline gas
LNG feedstock
Syn gas for chemicals (H2/CO)
Coal gasification
500 ppm CO2; 0.01ppm H2S CO2, H2S, COS SNG (high Btu gas)
Intermediate Btu gas
100 ppm H2S Low Btu gas
100 ppm H2S H2S Oil desulfurization
100 ppm H2S CO2, H2S, COS Refinery fuel gas treating
~1ppm H2S, 1ppm CO2 CO2, H2S Ethylene manufacture (steam cracker gas treating)
90% removal SO2 Flue gas desulfurization Utilities (electric)
Refineries, etc.
جدول 2-2: حد نشانة خلوص در فرآيند شيرينسازي
امروزه فرآيندهاي شيرينسازي متعددي وجود دارد كه يك مهندس طراح بايد با درنظرگرفتن پارامترهاي گوناگون يكي از آنها را انتخاب نمايد. حال به ذكر اين پارامترها ميپردازيم:
الف- نوع ناخالصي كه بايد از گاز جدا گردد.
ب- ميزان غلظت ناخالصي و حد نشانة خلوص گاز.
ج- جذب انتخابي گازهاي اسيدي.
د- ميزان گاز ترش و شرايط دما و فشار گاز.
ه- عملي بودن و مطلوب بودن واحد بازيافت گوگرد.
و- اقتصادي بودن فرآيند.
اغلب تركيبات گازهاي اسيدي CO2 و H2S و همچنين مركاپتانها و ديسولفيدكربن و يا سولفيد كربنيل ميباشند. بسته به نوع ناخالصي تنها ميتوان از برخي روشها استفاده كرد.
واكنشهاي برگشتناپذير محلول شيرينسازي و يا جداشدن گازهاي اسيدي از حلال سبب ميشود كه بسياري از فرآيندها غيرعملي و غيراقتصادي گردند.
برخي فرآيندها قابل اجرا براي جداسازي مقادير زياد گازهاي اسيدي هستند. در برخي از فرآيندها به مشخصات گاز استاندارد خطوط لوله نخواهيم رسيد. برخي فرآيندها ظرفيت جذب گازهاي اسيدي در حد ميليونيم را دارند و پارهاي تنها در مورد غلظتهاي كم گاز اسيدي در گاز ترش ميتوانند عمل كنند.
يك عامل انتخاب فرآيند، انتخابي بودن جذب يك جزء از گازهاي اسيدي در مقابل اجزاء ديگر ميباشد. در مواردي هم انتخابي بودن مهم نيست و تمام اجزاء بايد جدا شوند.
بعضي فرآيندها، هنگام عمليات با مقدار زياد گاز مزيت اقتصادي خود را از دست ميدهند. مطلوب بودن و امكانپذير بودن واحد بازيافت گوگرد، موضوع ديگري است كه انتخاب فرآيند را با محدوديت مواجه مينمايد. تا سال 1970 تصميم بر سر اينكه وجود واحد بازيافت به دنبال واحد شيرينسازي امري اقتصادي است يا نه،
مشكل بود. اگر تقاضايي براي سولفور توليد شده وجود داشت و يا قيمت سولفور از نظر اقتصادي كفايت ميكرد، آنگاه واحد سولفور نصب ميگرديد و در صورت اقتصادي نبودن گازهاي اسيدي سوزانده ميشد. با پيدايش مسألة بزرگتري چون محيط زيست، ذهنيت توليد گوگرد تغيير پيدا كرد.
در اغلب كشورهاي صنعتي تبديل هيدروژن سولفوره به گوگرد از مسأله اقتصادي آن مهمتر است.
هماكنون فرآيندهاي تصفيه گاز با حلالهاي شيميايي و فيزيكي روشهاي بسيار كاربردي ميباشد. جداسازي گازهاي اسيدي به صورت تودهاي (Bulk) و يا جزئي (Trace) ميباشد. در جدول (3-2)، روشهايي كه براي هر دو نوع جداسازي متداول ميباشد ارائه شده است.
Absorption in to a Liquid
Physical-Polar organic solvent Bulk removal
Chemical-solution of a base
Cryogenic separation
Absorption on to a solid
Zeolites, activated carbon, clays
Chemical conversation to another compound
Gas phase reaction, e. g., methanation Final or trace
Reaction with solid, e. g., F2e3O, ZnO Purification
Reaction with slurried solids (SO2)
Chemical oxidation (H2S)
Hydrolysis (COS)
جدول (3-2) روشهاي متداول در جداسازي تودهاي يا جزئي
روشهاي جذب سطحي و روش سردسازي براي جذب و جداسازي تودهاي مناسب ميباشند. روش جذب سطحي در مقايسه با جذب توسط مايع، قدرت جذب آن در واحدهاي كوچك خيلي بالاتر است. روش سردسازي كاربرد كمي در صنعت دارد.
در مورد جداسازي تا حد نهائي و جزئي (Trace) جذب سطحي توسط جامد و واكنش با مواد شيميايي كاربرد گستردهاي دارد.
در جدول (4-2) انواع روشهاي جداسازي گازهاي اسيدي توسط حلالهاي فيزيكي و شيميايي داده شده است. در بيشتر تأسيسات از حلالهاي شيميايي نظير آلكانول آمينها و فرآيند كربنات پتاسيم داغ استفاده ميشود. بيش از 2000 واحد تصفيه با حلالهاي شيميايي و كمتر از 100 واحد با حلالهاي فيزيكي كار ميكنند.
حلالهاي فيزيكي عموماً نظير الكلها، گلايكولها، كربنات پروپيلن و پروليون است.
Number of installations Solvent
> 1000 Acid gas removal
Aqueous alkanolamine
MEA
DEA
DGA
DIPA
> 740 Promoted hot potassium carbonate
Organic Promoters
Inorganic Promoters
> 130 Organic solvent-alkanolamine
Sulfolane/DIPA
MeOH/MEA/DEA
~ 100 A queous solution of potassium salt of amino acids
73 Physical (organic) solvents
Propylene carbonate
Polyethylene glycol dialkyl ether
N-methylpyrrolidone
Chilled methanol
~ 200 Flue gas desulfurization
Lime/limestone slurries in water
Sodium sulfite
جدول (4-2) انواع روشهاي جداسازي و تعداد تقريبي تأسيسات موجود
1-3-2- فاكتورهاي اقتصادي بر تصفيه گاز:
مقدار حلال در گردش تنها فاكتور اقتصادي مهم در تصفيه با حلالهاي شيميايي است. ميزان حلال در گردش بر تعيين اندازه پمپها، خط لوله، مبدلها، برج احياء و در نتيجه در ميزان سرمايه كارخانه نقش مهمي دارد.
ميزان حلال در ميزان انرژي حرارتي ريبويلرها و مقدار بخار، نقش تعيينكنندهاي دارد چون انرژي حرارتي ريبويلرها با ميزان حلال به صورت مستقيم تناسب دارد. سرعت انتقال جرم نيز بر روي ارتفاع برج و ميزان بخار مصرفي در ريبويلر اثر مستقيم دارد. در فرآيندهاي جداسازي انتخابي اجزاء اسيدي، سرعت انتقال جرم، بسيار مهم است.
از فاكتورهاي ديگري كه در مسائل اقتصادي نقش دارند ميتوان خورندگي محلول، قيمت حلال، جنس دستگاهها و ميزان حلال در گردش را نام برد.
همانطور كه گفته شد ظرفيت جذب و مقدار حلال در گردش تأثير مستقيمي بر روي سرماية واحد تصفيه دارد. جدول (5-2) ميزان سرمايه، هزينه و سوخت واحد شيرينسازي با حلال دياتانل آمين را در دو غلظت متفاوت نشان ميدهد.
High concentration Traditional Process
3.5 3.5 3.5 2.5 DEA cone, in water, molar
7.0 5.8 4.4 3.0 Acid gas loading, SCF/gal
744 892 1190 1736 GPM
0.56 0.62 0.76 1.0 Relative investment
0.33 0.42 0.63 1.0 Relative annual fuel cost
جدول (5-2) ميزان سرمايه، هزينه و سوخت در واحد شيرينسازي با غلظتهاي متفاوت حلال
همانطور كه در جدول (5-2) نشان داده شده، با افزايش غلظت دياتانل آمين (DEA)، ميزان حلال در گردش تا حدود 50 درصد كاهش مييابد و به دنبال آن بيش از 50 درصد ميزان سرمايه و بيش از 65 درصد هزينه سوخت واحد كاهش يابد.
البته بايد توجه داشت كه با افزايش غلظت حلال، مسأله خوردگي نيز شدت خواهد يافت چرا كه با غليظتر شدن حلال، ميزان جذب گازهاي اسيدي بيشتر شده و به دنبال آن خوردگي افزايش مييابد و براي رفع اين مشكل بايد از بازدارندههاي خوردگي استفاده كرد. جدول (6-2) مقايسه كلي روشهاي مختلف شيرينسازي را نشان ميدهد.
شرح كلي ABSORPTION Chem. ABSORPTION Phy. ABSORPTION Chem. ABSORPTION Phy.
چگونگي كيفيت جذب
چگونگي كيفيت جذب درجه خلوص بالا آسان درجه خلوص خيلي بالا آسان خلوص بالا آسان خلوص بالا نيست
نام برخي از مواد مربوطه Fe2O3, ZnO Activated Carbon Mol. Sieve الكانول آمينها متانول
مقدار انرژي مصرفي در قسمت احياء خيلي زياد مورد استفاده نيست متوسط زياد كم
H2S Selectivity خيلي زياد متوسط خيلي زياد كم
درصد خلوص مورد نياز خيلي زياد زياد زياد متوسط
هزينه انرژي خيلي زياد متوسط متوسط زياد
جدول (6-2) مقايسه روشهاي مختلف شيرينسازي
زماني كه ميزان ناخالصي يك تن در سال باشد، از روش جذب سطحي شيميايي استفاده ميگردد. اين روش اقتصادي نميباشد چون ماده جاذب قابل احياء و بازيابي نيست. اگر ميزان ناخالصي حدود هزار تن در سال باشد از روش جذب سطحي فيزيكي استفاده ميشود و براي بيشتر از هزار تن در سال از روش جذب توسط مايع استفاده ميشود. (Absorption)
4-2- آلكانول آمينها:
آلكانول آمينها مواد آلي نيتروژنداري هستند كه از تركيب مواد آلي مخصوص با آمونياك (NH3) به دست ميآيند. كلمةآمين در حقيقت به طور عام به چنين تركيباتي اطلاق ميشود. در واكنش اصلي يكي از هيدروژنهاي آمونياك با راديكال ماده شيميايي آلي تعويض ميگردد. در صنايع شيميايي انواع زيادي از آمينها مورد استفاده قرار ميگيرند.
آلكانول آمينها به طور عام براي تصفيه گازها و مايعات نفتي ترش بكار برده ميشوند. همانطوري كه از نام آلكانول آمين معلوم ميشود، ميتوان آنها را تركيباتي از الكل و آمونياك به حساب آورد. فرق بين آمينهاي مختلف در اينست كه چه مقداري از هيدروژنهاي آمونياك (NH3) با راديكال الكل اتانل C2H4OH جانشين شده است.
H H H
آمونياك H N اتانل OH C C H
H H H
H H H
مونواتانل آمين N C C OH
(MEA) H H H
H H
C C OH
H H
دي اتانل آمين H N
(DEA) H H
C C OH
H H
H H
C C OH
H H H H
تري اتانل آمين OH C C N
(TEA) H H H H
C C OH
H H
H H H
C C C OH
H H H
H N
H H H
C C C OH
H H H
H H
C C OH
H H H
H C N
H H H
C C OH
H H
H H H H H
دي گلايكول آمين N C C O C C OH
(DGA) H H H H H
در سال 1930 براي اولين بار ايدة استفاده از آمينها براي تصفيه گازهاي اسيدي CO2 و H2S از گازها و مايعات نفتي مطرح و مورد استفاده قرار گرفت. قبل از آن استفاده از آمونياك براي شيرينسازي گازها پيشنهاد گرديده بود ولي عيب عمدة آمونياك ميل تركيبي زياد آن با گاز كربنيك موجود در گاز و توليد مادة جامدكربنات آمونيوم بود.
همانطور كه در شكل مولكولي آمينها مشاهده ميشود هر مولكول از آمينها حداقل داراي يك گروه هيدروكسي (OH) و يك گروه آمينو (NH2, NH) ميباشند.
به طور كلي چنين استنباط ميشود كه گروه هيدروكسي با بالابردن وزن مولكولي موجب كاهش فشار بخار و باعث افزايش حلاليت آمين در آب ميگردد و آمينو قدرت بازي كافي در محلول آمينها در آب به منظور جذب گازهاي اسيدي توسط آنها را به وجود ميآورند.
5-2- معرفي انواع آمينها:
الف- مونو اتانل آمين (MEA):
MEA سبكترين آمين از نظر جرم مولكولي ميباشد ولي از نظر جذب گازهاي اسيدي چه از نظر وزني يا حجمي بيشترين ظرفيت را بين انواع آمينها دارا ميباشد.
MEA ميتواند CO2 و H2S را بدون در نظر گرفتن اختلافي بين آنها جذب كند. به علت بالابودن مقدار جذب MEA، با گردش مقدار كمتري از محلول مونواتانل آمين نسبت به آمينهاي ديگر ميتوان مقدار معيني از گازهاي اسيدي را جذب نمود.
MEA از نظر شيميايي پايدار است و به راحتي ميتوان آن را از گازهاي اسيدي جدا نمود. اين عمل با بالابردن درجه حرارت آمين اشباع بوسيلة بخار آب در برجهاي جداكننده صورت ميگيرد.
مشكل MEA اين است كه هنگام حضور دي سولفيد كربن و سولفيد كربنيل با آنها تركيب شده و تركيب به دست آمده خاصيت برگشتپذيري ندارد.
(1-2) سولفيد كربنيل COS + H2O H2S + CO2
(2-2) دي سولفيد كربن CS2 + 2H2O 2H2S + CO2
تشكيل دو ماده فوق در محيط و تركيب آنها با آمين موجب ميگردد كه آمين تركيب شده با آنها فاسد شده و از محيط خارج گردد. از واكنش آمين با مواد فوق مواد جامد تشكيل ميشود كه در دستگاهها توليد مشكل ميكند و تشكيل رسوب ميدهد.
فشار بخار MEA از ساير آمينها بيشتر است. بنابراين موجب ميگردد كه مقداري آمين به صورت بخار همراه با گاز شيرين خارج گردد. به منظور جلوگيري از هدررفتن آمين گاز شيرين خروجي از برج تصفيه را با آب شستشو ميدهند تا آب آمين را جذب كرده و دوباره در سيكل آمين بازيابي گردد.
ميزان جذب CO2 در مونواتانل آمين كمتر از H2S است. اين پديده به علت خاصيت جذب MEA نيست. بلكه CO2 براحتي جذب آمين ميگردد CO2 از آن جدا ميشود.
MEA به راحتي ميتواند غلظت گازهاي اسيدي را براساس مشخصات لوله انتقال گاز كاهش دهد (معمولاً كمتر از 0.25 گرين در 100 فوت مكعب گاز) با انجام طراحي صحيح و بهرهبرداري مناسب ميتوان ميزان گازهاي اسيدي را تا 0.05 گرين در هر 100 فوت مكعب كاهش داد.
خاصيت خورندگي مونواتانل آمين خالص بسيار پايين است و حتي از خورندگي آب نيز پايينتر ميباشد. محلول MEA را معمولاً 15 تا 18 درصد وزني به كار ميبرند. استفاده از محلول MEA با 15% غلظت و حتي كمتر ضمن كاهش مقدار خوردگي در لولههاي جوشآور و يا برج احياء، مبدلهاي آمين به آمين، بيشترين قابليت تغيير در پارامترهاي عملياتي را دارا ميباشند. بهرهبرداري از محلول MEA با غلظت بيشتر از %18 به طور جدي منع شده است.
در مقابل قابليت جذب بالاي MEA و قيمت نسبتاً ارزان آن و همچنين تمايل كم آن به جذب هيدروكربنهاي سنگين، معايب زير را نيز داراست:
- تجزيه آمين و ايجاد نمكهاي پايدار در برابر حرارت به مقدار زياد و خورندگي زياد نمكهاي ايجادشده.
- فراريت و هدرروي بالا در اثر تبخير به علت فشار بخار بالاي آن.
- عدم جذب مركاپتانهاي موجود در گاز ترش.
ب- دياتانل آمين (DEA):
مكانيزم عملكرد شيميايي دياتانل آمين در تصفيه و شيرينسازي گاز مانند مونواتانل آمين است. تفاوت عمده بين اين دو آمين در تركيب با سولفيد كربنيل و دي سولفيد كربن ميباشد كه دي اتانل آمين ميل تركيبي بسيار كمي با اين دو بنيان سولفوري دارد. DEA ميزان خورندگي كمي دارد، همچنين چون گرماي واكنش آن با گازهاي اسيدي كم ميباشد و امكان احياء نسبتاً راحتي آمين وجود دارد، در نتيجه ميتوان از غلظتهاي بيشتر آمين با ميزان بارگيري بالاتر استفاده نمود تا ميزان آمين در گردش لازم، كاهش داده شود.
محدودة كاركرد اين آمين در غلظت (25-35) درصد وزني آمين و بارگيري 0.35-0.65 مول گازهاي اسيدي به ازاء هر مول آمين ميباشد.
در اين فرآيند به علت بالابودن نقطه جوش (NBP = 5160F) عمل تميزسازي محلول از ناخالصيهاي موجود توسط دستگاه بازيابي مجدد Reclaimer صورت نميگيرد، بلكه اين ناخالصيها توسط فيلترهاي مكانيكي و ذغال فعال جدا ميشوند. نحوه عملكرد DEA انتخابي نبوده و H2S و CO2 را با هم از گاز ترش جدا ميكند ولي براي جذب مركاپتانها راندمان قابل توجهي ندارد.
ج- تري اتانل آمين (TEA):
تري اتانل آمين اولين ماده شيميايي از شاخه آمينها ميباشد كه در فرآيند شيرينكردن گازها مورد استفاده قرار گرفته است و به مرور جاي خود را به MEA و DEA داده است. TEA ميل تركيبي كمتري با گازهاي اسيدي دارد. اين ماده در مقايسه با دو آمين ديگر مقدار كمتري گاز اسيدي در واحد حجم ميتواند جذب نمايد و همچنين ميزان H2S باقيمانده در گاز شيرين در تصفيه با TEA بيشتر ميباشد.
تنها مزيت TEA نسبت به ساير آمينها Selectivity آن براي H2S است يعني در صورت وجود گازهاي اسيدي ديگر در محيط، TEA تمايل به تركيب با H2S را بيشتر دارد ولي آمينهاي ديگر ميل تركيب شدن و جذب كردن كلية گازهاي اسيدي موجود را در محيط تقريباً يكسان دارا هستند. احتمالاً اين خاصيت به دليل آن است كه TEA نميتواند با CO2 مستقيماً تركيب گردد در صورتي كه با H2S به طور مستقيم واكنش داده و آن را جذب ميكند.
چون در شيرين كردن گازهاي ترش تنها جداكردن H2S مورد نظر نميباشد لذا Selectivity اهميت چنداني در اين فرآيند ندارد. به همين دليل امروزه در تمام فرآيندهاي شيرين كردن گاز از DEA يا MEA استفاده ميشود. همچنين TEA تقريباً دو برابر DEA قيمت دارد.
د- متيل دياتانل آمين (MDEA):
اين آمين از نوع سوم ميباشد و گرماي واكش آن با گازهاي اسيدي كمتر ميباشد. در نتيجه به گرماي كمتري براي احياء نياز دارد. همچنين نسبت به جذب H2S در مقابل CO2 گزينشپذير ميباشد و تنها براي جداسازي H2S بكار ميرود (براي مثال براي تأمين خوراك بازيافت گوگرد).
اين آمين به طور معمول در غلظت 40-50 درصد وزني آمين و با بارگيري 0.2-0.55 مول گاز اسيدي به ازاء هر مول آمين، بكار ميرود و مشكلات هدرروي و خورندگي آن نسبتاً كم ميباشد.پ
ه- دي گلايكول آمين (DGA):
(DGA) نيز از آمينهاي نوع اول است و مانند MEA در فشار جزئي پايين گازهاي اسيدي به كار گرفته ميشود.
با توجه به برابربودن وزن مولكولي DGA با DEA (به طور تقريبي)، قابليت استفاده آن در غلظتهاي بالاتر (حدود 50-70 درصد وزني آمين) باعث ميشود تا ميزان آمين در گردش لازم كمتر از DEA باشد ولي به علت بالابودن گرماي واكنش جذب، نه تنها خوردگي افزايش پيدا ميكند، بلكه در قسمتهاي پايين برج جذب،
راندمان واكنش جذب كاهش مييابد. به همين دليل توصيه ميشود كه درجه حرارت جريان خوراك و آمين كم و بار ورودي به برج جذب تا حد امكان پايين آورده شود تا دماي جريان آمين پربار خروجي، در حد مطلوب نگهداشته شود. ميزان حلاليت مركاپتانها در DGA همانند DEA ميباشد.
• مزاياي DGA:
- امكان استفاده در آب و هواي سرد به علت پايين بودن نقطه انجماد (9.50F)
- قابليت بالا در جذب COS
- محدوده فشار كاركرد 10-400Psi
- دبي پايين محلول آمين در گردش.
• معايب DGA:
- اتلاف زياد حلال و بالارفتن هزينه عملياتي
- بالابودن دماي برج جذب و محلول پربار آمين
- خوردگي قابل توجه.
و- دي ايزوپروپانل آمين (DIPA):
اين فرآيند براي گازهاي ترشي كه به ميزان قابل توجهي حاوي COS ميباشند، مناسب است همينطور براي جذب H2S و COS از LPG توصيه ميشود. از معايب عمده آن ميتوان به تجزيه آن در مجاورت با حرارت و توليد نمك پايدار (Degradation) و تجزيه توسط CO2 اشاره كرد كه اين واكنشها برگشتناپذير بوده و ميزان آن از فرآيندهاي MEA و DEA بيشتر است. از اين آمين به عنوان حلال شيميايي فرآيند Shell Sulphinol استفاده ميشود.
6-2- خواص فيزيكي آلكانول آمينها:
خواص فيزيكي آلكانول آمينها در جدول (7-2) گردآوري شده است. اتانل آمينها مايعات شفاف و بيرنگ هستند. تمامي آنها به جز TEA از لحاظ شيميايي پايدار هستند چراكه تا رسيدن به نقطه جوش بدون تجزيه شدن حرارت ميبينند. TEA زير نقطه جوش نرمال 6800F تجزيه ميشود.
همچنين ثابتهاي معادلة آنتوان براي تخمين فشار بخار اتانل آمينهاي مختلف در جدول 7-2 داده شده است.
معادلة آنتوان عبارت است از:
P: فشار بخار برحسب mmHg
T: دما برحسب 0C
فشار بخار مخلوط اتانل آمين و آب را با در نظرگرفتن محلول ايدهآل ميتوان محاسبه نمود. ثابتهاي معادلة آنتوان براي آب عبارتند از:
A = 7.96681
B = 1668.21
C = 228
در جدول (8-2) خواص اصلي اتانل آمينها آورده شده است، فشار بخار مونواتانل آمين از ديگر آمينها بيشتر است و ميزان جذب مونواتانل آمين نسبت به ساير آمينها، صد در نظر گرفته شده است.
در نگاه اول مونواتانل آمين داراي مزيت ويژهاي است ولي در طراحي و انتخاب حلال پارامترهاي ديگري نيز بايد در نظر گرفته شوند.
Land1
جدول (7-2) خواص فيزيكي اتانل آمينها
MDEA DIPA DGA TEA DEA MEA
119.17 133.19 105.14 148.19 105.14 61.08 Mol. Wt:
0.0061 0.01 0.16 0.0063 0.0580 1.05 Vp at 100 F (mmHG):
51 46 58 41 58 100 Rel. Capacity%:
جدول (8-2) خواص اصلي و قدرت جذب نسبي اتانل آمينها
7-2- واكنشهاي شيميايي آلكانول آمينها:
فعل و انفعالات شيميايي آلكانول آمينها با H2S و CO2 به قرار زير است:
- واكنش MEA با H2S:
(3-2) (RNH3)2S 2RNH2 + H2S
(4-2) 2RNH3HS (RNH3)2S + H2S
- واكنش MEA با CO2:
(5-2) (RNH3)2CO3 2RNH2 + CO2 + H2O
(6-2) 2RNH3HCO3 (RNH3)CO3 + H2O + CO2
- واكنش DEA با H2S:
(7-2) (R2NH2)2S 2R2NH + H2S
(8-2) 2R2NH2HS (R2NH2)2S + H2S
- واكنش DEA با CO2:
(9-2) (R2NH2) CO3 2R2NH + CO2 + H2O
(10-2) 2R2NH2HCO3 (R2NH2)2CO3 + H2O + CO2
(11-2) R2NCOONH2R2 2R2NH + CO2
- واكنش TEA با H2S:
(12-2) (R3NH)2S 2R3N + H2S
(13-2) 2R3NHHS (R3NH)2S + H2S
- واكنش TEA با CO2:
(14-2) (R3NH)2CO3 2R3N + H2O + CO2
(15-2) 2R3NHHCO3 (R3NH)2CO3 + H2O + CO2
در واكنشهاي بالا گروه R همان اتانل است (C2H4OH)
نكته مهم در فرمولهاي شيميايي فوق وجود آب يا بخار آب در تركيب دياكسيدكربن با آلكانول آمينها ميباشد. زيرا وجود آب ميتواند مشكلات جداسازي دياكسيدكربن را از آلكانول آمينها برطرف سازد. جداسازي H2S از آلكانول آمينها در اثر حرارت به راحتي صورت ميگيرد زيرا فعل و انفعالات شيميايي فوق به صورت رفت و برگشتي نشان داده شده است.
در صورتي كه درجه حرارت پايين و در حدود درجه حرارت محيط باشد، فعل و انفعالات به طرف راست اتفاق ميافتد يعني در اين حالت CO2 و H2S جذب آلكانول آمين ميگردند. چنانچه درجه حرارت را افزايش دهيم فعل و انفعالات به سمت چپ حركت ميكند يعني نمكهاي تشكيل شده به سولفيد و كربنات تجزيه شده و گازهاي اسيدي از برج جداكننده خارج ميگردند.
8-2- غلظت محلولهاي آمين:
اولين اختلافي كه در بكارگيري MEA با DEA در شيرين كردن گاز وجود دارد، غلظت آنها ميباشد. MEA معمولاً با غلظت 10 تا 20 درصد وزني بكار ميرود كه متداولترين غلظت %15 وزني است.
درصد وزني DEA كه در فرآيند شيرينسازي گاز بكار ميرود براساس استاندارد SNPA بيش از 30% ميباشد. افزايش درصد وزني DEA به دليل زيادبودن جرم مولكولي آن نسبت به MEA ميباشد، اين افزايش غلظت DEA موجب ميشود كه نسبت مولي آمين به آب در محلول آمين در دو حالت كه MEA با حدود 15% و DEA با حدود 30% استفاده ميگردند برابر شود.
در شكل (1-2) مقدار نرماليته بازي محلولهاي آمين از نوع MEA، DEA و TEA را در غلظتهاي وزني مختلف نشان داده شده است. به طوري كه ملاحظه ميشود در نرماليتة ثابت حدود 2.5، غلظت وزني MEA %15 معادل با DEA%26 و معادل با غلظت حدود %34 براي TEA به دست ميآيد.
امروزه برخي از شركتهاي معروف شيميايي مواد افزاينده به آمينها موسوم به آمينگارد (Amine Guard) توليد و به بازار عرضه نمودهاند كه با بررسي و استفاده صحيح از آنها ميتوان غلظت محلول آمين را تا بيش از %50 بالا برد.
شكل (1-2): نرماليته بازي محلولهاي آمين در غلظتهاي مختلف
9-2- شرح كلي فرآيند آمين:
شماي كلي فرآيند آمين مطابق شكل (2-2) ميباشد. دستگاههاي مهم كه در اين فرآيند بكار ميروند شامل برج جذب (Absorber Column) و برج جداكننده (Stripper) همراه با مبدلهاي حرارتي، پمپ و لوله و اتصالات مربوطه ميباشد.
گاز ترش كه محتوي H2S و CO2 ميباشد. قبل از ورود به برج جذب به منظور جدانمودن مايعات و ذرات جامد همراه گاز، آن را از Scrubber عبور ميدهند. سپس گاز ترش از قسمت پايين برج جذب وارد شده كه از بالاي آن محلول آمين به طرف پايين در حركت است . گاز شيرين از قسمت فوقاني برج جذب شده و به سيستم آبزدايي فرستاده ميشود. (در بعضي موارد سيستم مراكس مرحلة بعدي ميباشد).
آمين فعال از قسمت پايين برج جداكننده به وسيلة پمپ پس از عبور مبدل حرارتي آمين – آمين و مبدل حرارتي (كولر) آبي يا هوايي به قسمت فوقاني برج جذب در خلاف جهت گاز ترش حركت مينمايد و گازهاي اسيدي موجود در گاز ترش را جذب مينمايد. آمين اشباع از گاز ترش (Rich Amine) از قسمت پايين برج جذب با داشتن فشار كافي پس از عبور از مبدل حرارتي آمين – آمين و گرفتن حرارت از قسمت بالا وارد برج جداكننده ميگردد.
شكل (2-2) نماي كلي از فرآيند آمين
مبدل حرارتي آمين – آمين به منظور جذب حرارت از آمين فعال و جلوگيري از اتلاف انرژي در سيستم تعبيه شده است. مقداري از گازهاي اسيدي جذب شده به محض ورود آمين اشباع به برج جداكننده از آمين جدا شده و به طرف بالاي برج حركت ميكنند. باقيمانده آمين اشباع به طرف پايين برج برخلاف جهت بخار توليد شده بوسيله جوشاننده حركت مينمايند.
بخار متصاعد شده از جوشاننده كه عمدتاً بخار آب ميباشد در حال بالارفتن به دليل خاصيت شناوري و حلاليت خوب آمين در آب گازهاي اسيدي آمين را به خود جذب نموده و به طرف بالاي برج حركت ميكند. گازهاي اسيدي و بخار آب از بالاي برج جداكننده خارج شده وارد يك مبدل حرارتي ميگردد كه در اين مبدل حرارتي بخار آب به صورت مايع درآمده و در يك مخزن جداكننده فرستاده ميشود. گاز اسيدي از بالاي مخزن جداكننده به مشعل يا به واحد مصرفكننده آن فرستاده ميشود.
آمين اشباع از قسمت پايين برج جذب با درجه حرارت معين كه مناسب جذب گازهاي اسيدي به واسطة آمين ميباشد خارج ميگردد. در مبدل آمين – آمين نميتوان تمام حرارت آمين را به آمين اشباع منتقل نمود. زيرا در اينصورت با بالارفتن درجه حرارت آمين اشباع ممكن است در لوله رابط دو فاز تشكيل شده و مشكلاتي به وجود آيد.
به همين دليل مبدل حرارتي آبي يا هوايي را بعد از آن در نظر ميگيرند كه درجه حرارت آمين فعال را به حدود 1000F برسانند. در صورتي كه درجه حرارت آمين فعال بيش از 1000F باشد امكان از دست دادن مقداري آمين از بالاي برج جذب و همچنين جذب كمتر گازهاي اسيدي بوسيلة آمين بخاطر بالابودن درجه حرارت وجود دارد.
10-2- بررسي مشكلات عمده در واحدهاي آمين:
1-10-2- خوردگي در سيستمهاي تصفيه با آمين و توصيههاي عملياتي:
از زمانيكه سيستمهاي تصفيه گاز با آمين ابداع و در سرويس قرار گرفتهاند مشكل خوردگي شايد مهمترين مسأله در اين سيستمهاي فرآورشي بوده است. خوردگي معمولاً در سيستم احياء آمين شامل ريبويلرها، برج احياء،
كندانسور و در ساير قسمتهاي سيستم مثل مبدلهاي حرارتي و پمپها بوجود ميآيد. مشكل خوردگي در تمام واحدهاي تصفيه گاز مورد بررسي دقيق قرار گرفته و با انجام تغييرات فرآورشي در سيستم و مصرف مواد بازدارنده مقدار آن به حداقل رسانده ميشود. سيستمهاي تصفيه گاز با آمين به علت طراحيهاي خاص و روشهاي بهرهبرداري مستعد آن هستند كه در معرض انواع خوردگي قرار ميگيرند.