بخشی از مقاله
مقدمه
موجودات بیولومینسانت در سرتاسر محیطهاي خشکی و آبی پراکندهاند و شامل باکتریها، حشرات، کیسهتنان، مرجانهاي آبی و غیره میشوند .(19) حشرههاي شبتاب یکی از صدها گونه جانوري میباشند که در دل تاریکی جنگلها میدرخشند. آنها از پرتوهاي نور ساطع شده به منظور فرستادن علائم تولید مثلی، دفاع و... به یکدیگر استفاده میکنند. گونههاي متنوعی از حشرههاي شبتاب و کلاً موجودات تولید کننده نور در طبیعت وجود دارند، اما آنچه این تکثر را به وحدت تبدیل میکند، وجود یک خانواده پروتئینی مشابه در تمامی آنهاست که مسئول انتشار
نور میباشد و همچنین بسته به گونه منتشر کننده نور، نورهایی با رنگهاي متفاوت و متنوع از موجودات منتشر کننده ساطع میشود .(38) این خانواده پروتئینی لوسیفراز نامیده میشود. لوسیفرازها آنزیمهایی هستند که براي انتشار نور از سوبسترایی به نام لوسیفرین همراه با ATP وMg2+
و اکسیژن مولکولی براي نشر نورهایی با رنگهاي متنوع استفاده میکنند (شکل-.(1
آنزیم لوسیفراز، دومرحله آنزیمی آدنیلاسیون -D لوسیفرین و اکسیژناسیون لوسیفریل- آدنیلات - Luciferyl-) (adenylate را کاتالیز میکند .(34)
174
مجله پژوهشهاي سلولی و ملکولی (مجله زیست شناسی ایران) جلد 26، شماره 2، 1392
-1 لوسیفراز با آدنیلاسیون گروه کربوکسیل لوسیفرین در حضور Mg2+ ATP باعث فعال شدن این سوبسترا میشود.
- 2 لوسیفراز همانند یک اکسیژناز (Oxygenase) عمل کرده و با اثر بر روي لوسیفریل- آدنیلات، ضمن تولید محصولات، ایجاد پرتو نوري میکند.
میزان آنزیمهاي لوسیفراز مولد نورهاي غیر اختصاصی در محیط سلولی، به مقدار نانومولار با استفاده از لولههاي تقویت کننده نوري (Photomutiplier tubes (PMTs) یا وسایل همراه با بار (Charge- coupled devices) تخمین زده میشوند(5 و .(37 این حساسیت بالاي اندازهگیري سطح آنزیم، لوسیفرازها را به نمایندگانی شایسته براي کاربردهاي گوناگون تبدیل کرده است که از جمله آنها عبارتند از: ردیابی مراحل رشد باکتریها در محیط، (15)
براي ردیابی باکتریها و سمهاي محیطی، 6)، 32 و (35
سنجش میانکنشهاي بیومولکولی بر پایه انتقال انرژي رزونانس بیولومینسانس، 3)، 28، 40 و (41 حسگرهاي زیستی بر پایه- کل- سلول،( (Whole-cell-based 16) biosensors، 17 و (36 سنجشهاي بیان ژن، 14)، 24
و (27 ردیابی رشد تومورهاي سرطانی و متاستاز، 7)، 29 و (42 مطالعه جزئیات حمل و نقل سلولی، (18-34) مطالعه جزئیات تنظیمات ژنتیکی،((8) (Cell traficking ترشح پروتئین درجایگاههاي ویژه، ( (Protein site-specific (15) secretion آنالیز بیماریهاي عفونی، (22) تعیین توالی
DNA با استفاده از لوسیفراز حشرهي شبتاب به روش Pyrosequencing ، (31) کاربرد بیولومینسانس در غربالگري داروها ( (Bioluminescence in drug (11-33) screening و کاربرد لوسیفراز در آزمونهاي
ایمنی(.(23) (Immuno assay
نکته قابل توجه اینکه، اغلب سنجشهاي بیان ژن نیازمند دو گزارشگر لوسیفرازي با دو رنگ متفاوت منتشرکننده با یک سوبستراي مشترك میباشند(.(5
شکل-1 واکنش کاتالیز شده توسط لوسیفراز حشره شبتاب
بهدست آوردن تککریستال، اولین مرحله در آنالیز ساختاري یک پروتئین به کمک اشعه x میباشد. کریستال کردن پروتئینها اساساً روشی مبتنی بر سعی و خطا بوده که در آن پروتئین از حالت محلول به آهستگی رسوب میکند.
حضور ناخالصیها، هستههاي کریستاله کننده و دیگر فاکتورهاي ناشناخته، نقش مهمی در این فرایند بر عهده دارند.
طی چند دهه گذشته، لوسیفرازهاي حشرات متفاوت شبتاب به طور گستردهاي مطالعه شدهاند که در این میان بیشترین تحقیقات روي لوسیفراز نوع آمریکاي شمالی با نام علمی Photinus pyralis انجام گرفته است. در شمال ایران (جنگلهاي آمل(((2 دو گونه حشره شبتاب با نام
Lampyris turkestanicus و Lamproidea maculata
مشاهده و گزارش شده است. گونه Lampyris
175
مجله پژوهشهاي سلولی و ملکولی (مجله زیست شناسی ایران) جلد 26، شماره 2، 1392
turkestancus به فراوانی یافت میشود در حالی که گونه L. maculata گونهاي نادر با ویژگیهاي ریختشناختی منحصر به فرد میباشد .(13)
بسته به فاکتورهاي متفاوت -که یکی از مهم ترین آنها اسیدآمینههاي تشکیل دهنده لوسیفراز است- از لوسیفرازها نورهایی با طیف رنگی متفاوت منتشر میشود. حشره
شبتاب گونه ایرانی با نام علمی Lampyris
turkestanicus حاوي لوسیفرازي است که پرتویی به رنگ سبز منتشر میکند(.(2 این گونه در جنگلهاي شمال ایران
(آمل) زندگی میکند. در این کار براي اولین بار کریستال
لوسیفراز جهش یافته گونه ایرانی Lampyris
turkestanicus -که نور قرمز ساطع میکند- تهیه شد(.(1
مکانیسمهاي متفاوتی جهت توجیه تغییر رنگ نور انتشار یافته از لوسیفرازها بیان شدهاند که براساس جدیدترین و آخرین نظریه این تغییر، در نتیجه دو فاکتور اصلی است و تنها به تک حالت تهییج شده شکل کتویی آنیون فنولات اکسی لوسیفرین وابسته است.
این دو فاکتور عبارتند از:
-1 قطبیت محیط جایگاه فعال لوسیفراز حول آنیون اکسی لوسیفرین
-2 میانکنش میان اتم O8' آنیون اکسی لوسیفرین حالت تهییج شده و اتم هیدروژن جفتکاتیون آن- شکل پروتونه ناحیه بازي آمینواسیدي در جایگاه فعال است- .(21)
به منظور بررسی مکانیسم تغییر رنگ نور-که هنوز هم به صورت معمائی باقیمانده است- حاصل از لوسیفراز جهش افته با سایر لوسیفرازهاي تعیین ساختار شده در مراحل بعدي کار، ساختار سهبعدي لوسیفراز با آنالیز پراش حاصل از کریستال تعیین گردید. (تلاشهاي اولیه براي تهیه کریستال لوسیفراز گونه طبیعی در شرایط یکسان با لوسیفراز جهش یافته بدون نتیجه ماند.)
مواد و روشها
بیان، تخلیص و تعیین فعالیت و غلظت پروتئین: بیان
پروتئین "جهش یافته" در باکتري اشرشیاکلی گونه BL21
حاوي پلاسمید بیانی pET28a در محیط کشت TB -که حاوي آنتی بیوتیک کانامایسین با غلظت50 میلی گرم در هر میلیلیتر بود- به انجام رسید. به این منظور ابتدا باکتري براي مدت4 ساعت در دماي 37 درجه سانتیگراد با دور
"r.p. m" 250 انکوبه شد و سپس بیان پروتئین با افزایش
mM1 IPTG و 4 میلی مولار لاکتوز القاء شد و باکتریها به مدت 12 ساعت در دماي 22 درجه سانتیگراد با دور 200
"r.p.m" انکوبه شدند.
بعد از هر بار کشت و تست بیان پروتئین به وسیله دستگاه فلوريمتر، دیواره باکتریها پس از معلق سازي در بافر لیزکننده غشاء (شامل mM 10 هپس ، mM 300 نمک کلرید سدیم، mM 10 ایمیدازول، 10 درصد گلیسرول در اسیدیته (7/8 و مقدار mM1 PMSF در سرما با استفاده از دستگاه FRENCH-PRESS در 2 تکرار متوالی شکسته شد. بقایاي باکتریها و اجزاي نامحلول آنها با استفاده از سانتریفیوژ با دور"12000 "r.p.m به مدت 20 دقیقه رسوب داده شد و به این ترتیب عصارهاي که حاوي کل پروتئینها بود، بهدست آمد.
از آنجا که پروتئین داراي دم-هیستیدینی است تخلیص پروتئین "جهش یافته" تنها با یک مرحله به وسیله ستون نیکل سفارز 5 میلیلیتري محصول شرکت کیاژن صورت گرفت. به منظور متعادل سازي ستون با بافر، شستوشوي ستون با 50 میلیلیتر بافر لیزکننده به ازاي هر یک لیتر محیط کشت -که حاوي 10میلی مولار هپس، 10 درصد گلیسرول، 300 میلی مولار نمک کلرید سدیم و mM 10
ایمیدازول در اسیدیته 7/8 در اتاق سرد است- با سرعت 5
صورت گرفت. عصاره باکتري حاوي پروتئین -که باز هم فعالیت آن قبل از تخلیص آزمایش شد- با سرعت 2-1 از ستون عبور داده شد. در مرحله بعدي از شیب متفاوتی از
176
مجله پژوهشهاي سلولی و ملکولی (مجله زیست شناسی ایران) جلد 26، شماره 2، 1392
محلولهاي شستشو با غلظتهاي متفاوت ایمیدازول به ترتیب استفاده گردید و در مرحله آخر محلول جداکننده پروتئین
از mM 60-40-30 در اسیدیته 8 با سرعت 4-3 و به از ستون با غلظت mM 250 ایمیدازول با اسیدیته 8 و
میزان حدود 40-35 میلیلیتر براي خالصسازي پروتئین سرعت 3 از ستون عبور داده شد (شکل .(2
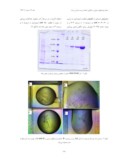
شکل - 2 ژل SDS-PAGE حاصل از تخلیص پروتئین لوسیفراز جهش یافته
شکل - 3 مراحل رشد کریستال لوسیفراز که شامل (a) رسوب پروتئین، (b) تشکیل کریستالهاي سوزنی و (c and d) در نهایت رشد کریستالها تا اندازه دلخواه میباشد.
177
Infinite M200
مجله پژوهشهاي سلولی و ملکولی (مجله زیست شناسی ایران) جلد 26، شماره 2، 1392
جدول-1 بافرهاي متفاوت امتحان شده به منظور تست میزان حلالیت و پایداري پروتئین
بافر نمک کلرید سوکروز گلیسرول پلی اتیلن pH
سدیم گلیکول
1 تریس mM 10 mM 50 %1 %10 7/8
2 تریس mM 10 mM 50 %10 7/8
3 هپس mM10 mM 50 %1 %10 7/8
4 هپس mM10 mM 50 %10 7/8
5 هپس mM10 mM 100 %1 %10 6/8
6 هپس mM10 mM 100 %10 6/8
7 هپس mM10 mM 100 %1 %10 %25 6/8
8 هپس mM10 mM 100 %1 %10 7
10 میکرولیتر محلول حاوي پروتئین را -که شامل بافر
100-10 میکرولیتر هپسmM 10 همراه با mM 150-100
نمک کلرید سدیم و 10 درصد گلیسرول و 1 درصد سوکروز در اسیدیتههاي متفاوت 7/8 و 6/8 و 7 و 10
میکرولیتر بود- را با محلول کمپلکس حاوي 5 میلی مولار لوسیفرین، نمک کلرید منیزیم با غلظت mM 5 و ATP با غلظت mM2 در بافر تریس با اسیدیته 7/8 مخلوط کرده، بعد از گذشت حدود یک دقیقه براي تطابق محلولها با
دماي محیط، فعالیت پروتئین با دستگاه
(TECAN) ثبت گردید(.(1
تعیین غلظت پروتئین: جذب نوري محلولهاي متفاوت حاوي پروتئین را با استفاده از دستگاه اسپکتروسکوپی اشعه ماوراءبنفش در 280 نانومتر اندازهگیري شد. براي محاسبه وزن مولکولی پروتئین، نیاز به "ضریب خاموشسازي" پروتئین است که این ضریب به صورت تئوري با استفاده از جعبه Pro Param در سایت Expasy
و تنها با وارد نمودن توالی پروتئین محاسبه گردید.
"ضریب خاموش سازي" لوسیفراز گونه ایرانی 38 بود.
کریستالوگرافی اشعه X پروتئین: دیالیز و نگهداري
پروتئین: دیالیز محلول پروتئینِی حاوي mM 250
ایمیدازول حاصل از تخلیص، با استفاده از کیسه دیالیز شرکت سیگما در اتاق سرد و با غلظت پروتئینی حدود 2 mg/ml به مدت12 ساعت انجام گرفت. به ازاي هر ml 1
محلول پروتئین، یک لیتر محلول بافر دیالیز (بافرهاي متفاوت ذکر شده در جدول (1 استفاده شد.
تست بافرهاي متفاوت که غلظتهاي بالاي پروتئینی در
آنها داراي بالاترین پایداري باشد: یکی از مهمترین مراحل انجام کریستالوگرافی، تهیه بافري است که پروتئین در آن بافر، بالاترین پایداري را (به لحاظ عدم رسوب و محلول ماندن پروتئین فعال در مدت طولانی) در غلظتهاي بالاي مورد نیاز براي تشکیل کریستال داشته باشد. این نکته نیز قابل توجه میباشد که این افزایش پایداري باید با حفظ فعالیت آنزیم در طولانی مدت همراه باشد. براي تحقق این امر پروتئین در بافرهاي متفاوتی حل گردید (جدول .(1
کریستال کردن پروتئین: کریستالهاي لوسیفراز جهش یافته با استفاده از روش "قطره نشسته" بهدست آمد. خوشهاي از کریستالهاي سوزنی در شرایط متفاوتی رشد کردند (شکل
(3-4، اما ضخیمترین و طویلترین کریستالها بعد از حدود یک هفته در دماي 20 درجه سانتیگراد در تاریکی، در 500 نانولیتر بافر، حاوي mg/ml 4 لوسیفراز، mM 10
178
مجله پژوهشهاي سلولی و ملکولی (مجله زیست شناسی ایران) جلد 26، شماره 2، 1392
سدیم- هپس، EDTA mM 1 ، 10 درصد (V/V)
گلیسرول، 1 در سوکروز، mM 100 نمک کلرید سدیم و 5
DTT mM در اسیدیته 7 با 500 نانولیتر محلول رسوب دهنده، حاوي4 درصد PEG8000 (w/v)، 14 درصد اتیلن گلیکول، mM 100 سدیم- هپس در اسیدیته 7/5 تشکیل
شد (شکل .(4
آماده سازي محلولهاي "محافظ در برابر سرما"
(Cryoprotectant) براي حفظ کریستال در برابر صدمات
ناشی از اشعه : X یکی از مهمترین مراحل در کریستالوگرافی، تهیه و استفاده از محلول محافظتکننده کریستال در برابر آسیب ناشی از تابش اشعه X به منظور
افزایش طول عمر کریستال در حین تابش اشعه X
میباشد. معمولاً محلولهایی با تشابه بالا به شرایط محلول رسوب دهندهاي که کریستال در اثر آن رشد کرده است، بهترین محلولها براي حفاظت پروتئین در برابر اشعه X و
حفظ پایداري کریستال هستند. در این آزمایش محلولهاي زیر تهیه شده و به منظور اطمینان از مفید بودن آنها، کیفیت محلولها با استفاده از تولید کننده اشعه X آزمایشگاهی بررسی شد.