بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
رابطه دوبروی
الکترون و سایر ذره ها دارای خواص موجی هستند.
اسلاید 2 :
اصل عدم قطعیت هایزنبرگ
تعیین همزمان مکان دقیق و اندازه حرکت دقیق یک جسم کوچک به اندازه الکترون غیر ممکن است.
اسلاید 3 :
معادله شرودینگر بر اساس مکانیک کوانتوم
شرودینگر با بکار بردن رابطه دوبروی معادله ای برای توصیف الکترون بر مبنای خصلت موجی آن بیان کرد، که این
معادله به صورت تابع موجی بود.
در مکانیک کوانتوم هر الکترون با چهر عدد کوانتومی مشخص می شود.
1- عدد کوانتومی اصلی n ...،1،2،3n=
2- عدد کوانتومی فرعی l (1-n)،...،0،1،2l=
3- عدد کوانتومی مغناطیسی ml l+ ml= -l, …,
4- عدد کوانتومی اسپین ms 1/2+ ،1/2- ms=
اسلاید 4 :
عدد کوانتومی اصلی(n)
نشان دهنده لایه یا تراز انرژی است که الکترون به آن تعلق دارد وفاصله نسبی الکترون از هسته را نشان می دهد.
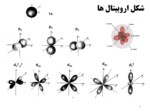
اسلاید 5 :
عدد کوانتومی فرعی یا اندازه حرکت زاویه ایی (l)
شمار لایه های فرعی برابر مقدار n می باشد
برای نمایش لایه های فرعی از حروف استفاده می شود
l= s, p, d, f, g, h, …
l= 0, 1, 2, 3, 4, 5, …
تعداد اوربیتالها در هر لایه فرعی
اسلاید 6 :
عدد کوانتومی مغناطیسی ml
ناشی از حرکت الکترون در یک مدار بسته به دور هسته است
اسلاید 7 :
عدد کوانتومی اسپین (ms)
اسلاید 8 :
نام عناصر
1- ازخاصیت آن عنصر
2- از نام مکانی که آن عنصر در آن مکان کشف شده است
3- از نام کانی که شامل آن عنصر است
4- از کاربردی که آن عنصر دارد
اسلاید 9 :
مثال
در اتم کلر(Cl ) تعداد پروتون ها، نوترون ها و الکترون ها را حساب نمائید.
اسلاید 10 :
یون
ذره بار داری که دارای یک یا چند اتم باشد.
بار منفی کل + بار مثبت کل= بار یون
بار کل الکترون ها + بار کل پروتون ها= بار یون
تعداد الکترون ها - تعداد پروتون ها= بار یون