بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
فهرست مطالب:
پديده فوق مزدوج شدن (هيپرکانژوگاسيون)
اثر آنومري
فوق مزدوج شدن منفي (هيپرکانژوگاسيون منفي)
نقش مفهوم اسيد و باز در توجيه مکانيسم واکنش ها
اسلاید 2 :
برهمکنش بين پيوند هاي σ و π را فوق مزدوج شدن يا هيپرکانژوگاسيون مي نامند.
زماني چنين اتفاقي حاصل مي شود که پيوند σ با اربيتال هاي پيوند π و يا اربيتال P در کربوکاتيون ها، کربانيون ها و راديکال ها موازي شده تا امکان همپوشاني فراهم شود.
اسلاید 3 :
1. استدلال در خصوص پايداري بالاي کربوکاتيون هاي نوع سوم، بدليل امکان 9 بار عمل فوق مزدوج شدن پيوندهاي σ با اربيتال هاي P كربوكاتيون مي باشد.
عمل فوق مزدوج شدن همچنين موجب افزايش پايداري پيوندهاي دوگانه به وسيله گروه هاي آلکيل است، به همين دليل هر چه آلکن پر استخلاف تر باشد، پايدارتر است (قاعده سايتزف ).
2.كوتاهتر بودن طول پيوند (C – C) آليليک نشان دهنده فوق مزدوج شدن و سست شدن اين پيوند با توجه به رزونانس فوق جهت پايدار نمودن پيوند دوگانه مي باشد
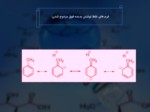
3. يکي ديگر از مواردي که فوق مزوج شدن را تائيد مي كند، هدايت کنندگي به موقعيت هاي اورتو و پارا در حلقه هاي با استخلاف آلکيل است که به علت فرم هاي رزونانسي زير است :
اسلاید 4 :
همپوشاني اربيتال هاي ناپيوندي با ٭σ ، ٭π يا اربيتال خالي P را اثر آنومري مي نامند
اين اثر شامل برهم کنش بين جفت الکترون ناپيوندي و اربيتال ضد پيوندي پيوند کربن‐هيدروژن و يا به عبارتي ديگر انتقال الکترون از جفت ناپيوندي به اربيتال ضد پيوندي (٭σ) پيوند کربن- هيدروژن، کربن– هالوژن و ... ميباشد
اسلاید 5 :
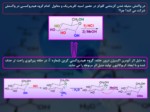
اثر آنومري سه اتم نيتروژن با اربيتال ضد پيوندي، پيوند کربن ‐ هيدروژن موجب شده است که هيدروژن نشان داده شده (هيدروژن متصل به كربن نوع چهارم) بتواند به صورت هيدريد) ۤ (H آزاد گردد، بنابراين واکنش به سمت تشکيل گاز هيدروژن، کامل است.
اسلاید 6 :
در واكنش، متيله شدن گزينشي گلوکز در حضور اسيد کلريدريک و متانول كدام گروه هيدروكسي در واكنش شركت مي كند؟ چرا؟
به دليل اثر آنومري اکسيژن درون حلقه، گروه هيدروکسي کربن شماره 2 در حلقه پيرانوزي راحت تر حذف شده و با ايجاد کربوکاتيون توليد متيل اتر مربوطه را مي نمايد.
اسلاید 7 :
علت پايداري صورتبندي گوچ در 1، 2- دي فلوئورواتان نيز همان اثر فوق مزدوج شدن بين *C-F σ و C-H σ مي باشد.
اسلاید 8 :
همپوشاني اربيتال هاي غير پيوندي يک اتم منفي با ٭σ را فوق مزدوج شدن منفي مي نامند.
فوق مزدوج شدن منفي عبارتي است که براي بيان پايداري گونه هاي آنيوني به وسيله عدم استقرار پيوند σ معرفي شده است، که اينگونه موارد شامل اربيتال هاي ٭σ به عنوان پذيرنده مي باشند.
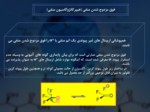
در ساختار زير طول پيوند کربن ‐ اکسيژن از حالت معمولي کوتاه تر و همچنين طول پيوند کربن ‐ فلوئور به ميزان قابل توجهي بزرگتر از حد معمول مي باشد.
اسلاید 9 :
خاصيت الکتروفيلي و نوکلئوفيلي نمونه هاي آشنائي از مفهوم اسيد و باز لوئيس هستند.
با توجه به اينکه کربن جزء اصلي اکثر واکنش هاي شيميائي مي باشد، پس خاصيت الکتروفيلي و نوکلئوفيلي آن بررسي مي گردد. اگرچه اين بررسي قابل بسط به اتم هاي ديگر نيز مي باشد.
الکتروفيلي (الکترون دوستي):
خاصيتي است که در مراکز با دانسيته بار مثبت مشاهده مي گردد.
اين مراکز به دليل اتصال کربن به اتم يا گروهي از اتم ها با الکترونگاتيويته بالا ايجاد مي گردد. هرچه اختلاف الکترونگاتيوي گروه هاي متصل به كربن نسبت به كربن بيشتر باشد، پيوند بين دو مرکز قطبيده تر شده و خاصيت الکتروفيلي روي اتم کربن، به عنوان مرکز با دانسيته پائين تر بيشتر مي شود.
هيبريداسيون کربن الكتروفيل مي تواند SP3، SP2 و SP باشد.
نمونه مراکز الکتروفيل با هيبريداسيون SP3، کربن متصل به هالوژن ها يا ديگر گروه هاي الکترونگاتيو بوده که شامل يک پيوند قطبي مي باشند (Rδ+ --- Xδ-).
اسلاید 10 :
در کربن هاي SP2 مثل گروه کربونيل خاصيت الکتروفيلي شديدتر است، زيرا در اين حالت قطبش علاوه بر پيوند σ در پيوند π نيز رخ داده و با توجه به اينکه قطبش پذيري در پيوند π آسانتر است، ابر الکتروني پيوند دوگانه به سمت اتم اکسيژن متمايل شده و اتم کربن دانسيته بار مثبت بيشتري را احساس مي کند (حد نهائي قطبش پذيري، انتقال کامل زوج الکترون پيوند π به اکسيژن است که به عنوان فرم رزونانسي گروه کربونيل شناخته مي شود) و حمله نوکلئوفيل به اين مرکز آسانتر صورت مي گيرد. ممانعت فضائي کمتر در حمله به کربن SP2 نيز در خاصيت الكترون دوستي كربن كربنيلي موثر مي باشد.
از کربن هاي الکتروفيل با هيبريداسيون SP نيز مي توان به گروه هاي استيلني مزدوج با گروه هاي کشنده مانند گروه کربونيل و گروه سيانيد و ... اشاره نمود.
ترکيبات عناصر گروه سوم اصلي نيز به علت داشتن اربيتال P خالي و ترکيباتي که داراي اربيتال هاي d خالي با سطح انرژي مناسب هستند، توان پذيرش زوج الکترون و عمل به عنوان يک اسيد لوئيس را دارند.
به طور کلي هر اتمي که توانائي پذيرش زوج الکترون از يک نوکلئوفيل را داشته باشد جزء اسيدهاي لوئيس به حساب مي آيد.