بخشی از مقاله
ویروس (John Cunningham) JC و اهمیت آن
چکیده
ویروس JC به خانواده Polyomaviridae تعلق داشته دارای اندازه 40 نانومتر، بدون پوشش، تقارن بیستوجهی، ژنوم DNA دو رشتهای حلقوی و بهاندازه 5130 جفت باز (پروتوتایپ) است. ژنوم، کد کننده 7 پروتئین مهم میباشد. شواهدی وجود دارد که این ویروس براثر ورود از راه دستگاه تنفسو احتمالاً به دنبال ویرمی اولیه همراه با عفونت لنفوسیتهای خون محیطی و مغز استخوان در دوران کودکی، در بافتهای مشخصی بهصورت نهفته و مزمن، استقراریافته و پس از عواملی نظیر بارداری، افزایش سن، پیوند اعضا و دیگر عواملی که منجر به سرکوب سیستم ایمنی میگردند مانند بیماران آلوده به HIV، بیماران مبتلابه لنفوم، گیرندههای پیوند اعضاء، بیماران مبتلابه مالتیپل اسکلروزیس (MS) و بیماران تحت درمان شیمیدرمانی، فعال گردیده، تکثیر و انتشاریافته سپس وارد مغز شده و ماده سفید و سلولهایی که مسئول ساخت میلین هستند را موردحمله قرار میدهد و باعث لکوانسفالوپاتی چند کانونی پیشرونده (PML) میگردد. علاوه بر PML این ویروس باعث سندرم دست ناسازگار نیز میشود، همچنین به نظر میرسد آنتیژن T مسئول سرطانزایی ویروس JC میباشد. مواردی از عقیمی در مردان نیز گزارش گردیده است. به علت اینکه فراوانی آلودگی به ویروس در جمعیت بالا میباشد، شناسایی این ویروس میتواند در تشخیص آلودگی مدفوعی در آب آشامیدنی مورداستفاده قرار بگیرد. امروزه از این ویروس برای انتقال هدفمند ژن و اطلاعات افراد بومی ناحیه و بررسی امنیتی برای مهاجرت غیرقانونی بهعنوان مارکر زیستی نیز استفاده میگردد.
کلید واژه: ویروس JC، ارزش تشخیص John Cunningham، PML، سرطان
مقدمه
ویروس JC در سال 1965 توسط Chou و همکاران کشف شد و ژنوم کامل آن در سال 1984 توسط Frisque و همکاران توالی یابی و به نام mad-1 برگرفته از شهر Madison نامگذاری گردید. از بین رفتن میلین بر روی سلول عصبی که باعث PML میشود و گنجیدگیهای داخل هستهای در الیگودندروسیت های طویل شده و آستروسیت های غیرطبیعی در هیستولوژی بافت مغز، پژوهشگران را بر آن داشت تا مظنون به علت ویروسی گردند. تلاشها برای شناسایی علت این بیماری نادر بینتیجه ماند تا اینکه Padgett و همکاران در آمریکا موفق به تولید محیط کشت مناسبی برای پیش ساز الیگودندروسیت ها و آستروسیت ها گردیدند و
1
توانستند تکثیر ویروس JC را در این سلولها به اثبات برسانند(.(Padgett et al, 1971 بر این اساس JCV اولین بار درسال 1971 از یک مورد مبتلابه PML و سندرم Hodgkin جداسازی گردید و بر اساس نام و نام خانوادگی بیمار John Cunningham
نامگذاری شد .(Pinto and Dobson , 2014)
ساختار پروتئینها و ژنوم ویروس
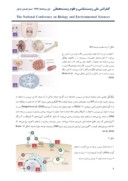
ویروس JC به خانواده Polyomaviridae تعلق داشته، بدون پوشش، دارای تقارن مکعبی (به قطر(40nm، حاوی ژنوم DNA دو رشتهای حلقوی بهاندازه 5,130bp (پروتوتایپ) میباشد. البته واریته هایی با طول متفاوت ژنوم به دلیل تفاوت نواحی کد کننده نیز گزارش گردیده است (شکل.(1 ژنوم، کد کننده 6 پروتئین مهم ویروسی ازجمله آنتیژن T بزرگ، آنتیژن T کوچک، آگنوپروتئین و پروتئینهای VP1،VP2 و VP3 میباشد. همچنین حاوی ژنهای تأخیری و اولیه بوده که توسط نواحی کنترلکننده غیر کد شوندهای که حاوی منطقه شروع همانندسازی، پروموتر و عناصر افزاینده هستند، مجزا میگردند. کپسید از سه پروتئین ساختمانی ویروس شامل، VP1، VP2 و VP3 تشکیلشده است که VP1 بهعنوان جزء اصلی میباشد. 72 پنتامر وجود دارد که هرکدام متشکل از پنج مولکول VP1 و یک مولکول VP2 یا VP3 میباشد. تنها VP1 در سطح کپسید مشاهده میشود و حاوی لیگاند اختصاصی میباشد. هیچگونه هگزامری مشاهده نشده است (Ferenczy et al, 2012)، ( Maginnis and Atwood, .(2009
شکل .1 نمای شماتیک از ژنوم JCV
ژنوم حلقوی Mad-1، 5130 جفت باز بوده و کد کننده 9 پروتئین: آنتیژن
T، آنتیژن t، VP1، VP2، VP3، T’135، T’136، T’165 و
آگنوپروتئین میباشد. در بالا منطقه کنترلکننده غیر کد شونده (NCCR) قرار دارد که شامل منطقه شروع تکثیر (ORI) و دو منطقه تکرارشونده 98 جفت بازی میباشد. واحد نقشه در مرکز دایره نشان دادهشده است. اولین الگوی بازخواندن (ORF) از NCCR در جهت خلاف عقربههای ساعت و درORF تأخیری در جهت عقربههای ساعت نشان شده است. پروتئین ها در قالب قرائت مشابه در رنگ مشابه کشیده شده است. مکانهای شروع و پایان نمایش داده شده است. تمامی رونوشت ها پلی آدنیله شدهاند .(Ferenczy et al, 2012)
ویریون شامل 88 درصد پروتئین و 12 درصد DNA میباشد. این ویروس در حال حاضر دارای 18 ژنوتایپ میباشد که 14 ژنوتایپ آن بهخوبی شناساییشده است و منحصر به منطقه خاص میباشد. ژنوتایپ های 1 تا 8 از اهمیت به سزایی برخوردار میباشند.
2
تایپهای 1 و 4 در اروپا و جمعیتهای بومی در شمال ژاپن، شمال شرق سیبری و شمال کانادا یافت شده است که این دو تایپ به یکدیگر وابسته میباشند. تایپهای 3 و 6 در کشورهای جنوب صحرای آفریقا یافت شدهاند، تایپ 3 از اتیوپی، تانزانیا و جنوب آفریقا جداسازی گردیده است. تایپ 6 در غنا یافت شده است. هر دو تایپ 3 و 6 در Biaka Pygmies و Bantus در آفریقای مرکزی یافت میشوند. تایپ 2 دارای واریته های مختلف است. زیر تایپ2A بهطور عمده در ژاپنیها و آمریکاییان بومی دیدهشده است. زیر تایپ 2B در نژاد مختلط آسیایی- آفریقایی دیدهشده و زیر تایپ 2D در هندوستان و E2 در استرالیا و غرب اقیانوس آرام مشاهدهشده است. زیرتایپ 7A در جنوب چین و جنوب شرق آسیا یافت میشود. زیرتایپ 7B در شمال چین، مغولستان و ژاپن و زیر تایپ7 C در شمال و جنوب چین گزارش گردیده است. تایپ 8 در پاپوآ گینه نوو جزایر اقیانوس آرام مشاهدهشده است .(Ferenczy et al, 2012)
اپیدمیولوژی
نمونههای دریافتی از افراد سالم بیانگر درصد 90-50 درصدی مواجه این افراد با JC ویروس بوده است که 19 تا 27 درصد این افراد ویروس را از ادرار خود دفع میکنند. شناسایی سرولوژی این ویروس با افزایش سن بالا میرود ولیکن هیچگونه علائم کلینیکی را نشان نمیدهد. فراوانی رخداد PML در بیماران به ترتیب 80 درصد در مبتلایان به ایدز، 13 درصد در سرطانهای خونی، 5 درصد دریافتکنندگان پیوند اعضا، 2 درصد بیماران مزمن التهابی میباشد. شیوع این بیماری در بیمارانی که تحت درمان با آنتیبادیهای مونوکلونال مانند Natalizumab، Rituximab، Efalizumab و یا Alemtuzumab رو به افزایش میباشد. حدود 3 درصد زنان باردار این ویروس را از ادرار خود دفع میکنند. یافتهها حاکی از آن است که آنتیژن T بزرگ در ویروس JC در 28 تا 30 درصد سرطانهای روده بزرگ مشاهدهشده است درصورتیکه دیگر پروتئینهای این ویروس در 16 درصد این بافتها حضور دارند و علاوه بر این مشاهدهشده است که مقدار این آنتیژن در تومورهای خوش خیم کم یافت میباشد و در بافتهای سالمی که با سلولهای غیرطبیعی احاطهشدهاند مشاهده نگردیده است .(Pinto and Dobson , 2014)
بیماریزایی
روند عفونت
عفونت اولیه توسط این ویروس طی استنشاق در بافت لوزه رخداده (شکل (2 اگرچه انتقال توسط غذا و آب آلوده نیز به اثبات رسیده است. لنفوسیتهای عفونیشده بافت لوزه ویریونهای این ویروس را به مغز استخوان و کلیهها حمل می کنند که این مکانها به نظر میرسد مکانهای اولیه برای نهفتگی ویروس میباشد .(Brew et al , 2010)
چگونگی عفونی شدن سلولها توسط این ویروس ناشناخته است اگرچه شواهد حاکی از آن هستند که این ویروس با استفاده از پروتئین کپسید خود به نام VP1 وارد سلولهای حساس توسط اتصال به -Nگلیکوپروتئینی با پیوند آلفا 2 و 6 به قسمت سیالیک اسید یا به گیرندههای 5 هیدروکسی تریپتامین 2 آ (H52a) به سلول متصل شده و وارد آن میشود(.(Maginnis et al, 2010 پس از ورود به سلول این ویروس با اتصال به کمپلکسهای منافذ هسته به هسته سلول راه مییابد. پوشش برداری از ویروس و برهنه شدن DNA در هسته رخ میدهد و ژنهای اولیه رونوشت برداری میشوند که شامل کدگذاری آنتیژنهای T کوچک و T بزرگ (آنتیژنهایی که برای تنظیم همانندسازی ضروری هستند) میباشند. سپس رونوشت برداری از ژنهای تأخیری رخ میدهد که کدکننده پروتئینهای کپسید و آگنوپروتئین (پروتئین ضروری برای ترمیم DNA و پیشرفت چرخه سلول) هستند (شکل Brew ) (3 .(et al, 2010
شکل .3
-1مرحله اتصال ویروس توسط دو نوع گیرنده به نامهای گیرنده H52a و گیرنده کربوهیدرات، -2 ورود به سلول، -3 ورود به هسته سلول، -4 پوشش برداری در هسته.
4
2
1
3
4
مکانهای عفونت در مغز، این ویروس سلولهای الیگودندروسیت و آستروسیت را آلوده نموده و سلولهای عفونی با ظاهری بزرگ و محتوی
ویریونهایی در هسته میکند. لیز شدن سلولهای الیگودندروسیت آلوده به دلیل آزاد شدن ویریونها به محیط خارج سلولی بوده و باعث تسهیل عفونت سلولهای مجاور میشود. در سطح ماکروسکوپی مکانهای عفونت ویروس JC در مغز مانند دمیلینه شدن قسمت سفید ضایعات با مرزهای نامنظم میباشند. عوامل میزبان، مانند توانایی پاسخ ایمنی سلولی، بدون شک در استعداد ابتلا به عفونت با ویروس JC مهم است. در بعضی موارد ویروس JC تنها سلولهای گرانولی مخچه را آلوده مینماید که در این موارد باعث آتروفی مخچه میگردد. این حالت تنها در مبتلایان به ایدز رخ میدهد. بااینحال، شواهد بافتی از عفونت ویروس JC در سلولهای گرانولی مخچه دربیماران مبتلابه PML بدون ابتلا به HIV یافت شده است. گرچه سلولهای اپیتلیال روده بزرگ اجازه ورود به ویروس و تکثیر را نمیدهند ولیکن ویروس میتواند باعث عفونت پنهان شناسایی نشده گردیده و باعث ایجاد سلولهای غیرطبیعی دگرگونشده و منجر به سرطان گردد .(Brew et al , 2010)
مکانهای نهفتگی و فعالیت مجدد
PML درنتیجه یک سری وقایع پشت سر هم به دلیل آغاز فعالیت مجدد ویروس JC به دنبال سرکوب سیستم ایمنی ایجاد میشود؛ اگرچه بیمارانی که در سنین پایین مبتلابه PML میشونداحتمالاً این رخداد درنتیجه عفونت اولیه با ویروس اتفاق میافتد. یافتهها نمایانگر فعالیت مجدد این ویروس خارج از سیستم عصبی مرکزی بوده و در اثر انتقال ویروس فعالشده توسط سلولهای B به مغز میباشد. بااینوجود فعالیت مجدد ویروس در افراد با ایمنی سرکوبشده در سیستم عصبی مرکزی رخ میدهد ( Brew et al, .(2010
یکی از عوامل احتمالی وقوع اختلال PML در بیماران، درمان با Natalizumab، Efalizumab، Rituximab، Alemtuzumab بوده است که از عوارض جانبی آن ایجاد این اختلال میباشد. Natalizumab، یک آنتاگونیست برای 4- اینتگرین میباشد که مانع واکنش میان لوکوسیتهایی که این اینتگرین را بیان میکنند مانند لنفوسیتها، منوسیتها، ائوزینوفیلها و بازوفیلها و رسپتور 1 مولکول ادهسین عروقی که در سلولهای اندوتلیال وجود دارد، بنابراین Natalizumab، باعث ممانعت از فعالیت سیستم ایمنی آن سوی سدهای بافتی، نظیر سد خونی- مغزی میگردد. همچنین در بیماران مبتلابه MS و تحت درمان با Natalizumab، همراه با کاهش سلولهای CD4+/CD8+ T در مایع مغزی نخاعی میباشد. اگر مغز یکی از مکانهای نهفتگی این ویروس باشد استفاده از Natalizumab، ممکن است باعث ایجاد PML گردد. Efalizumab به زیر واحد CD11a که در فعالیت لوکوسیت در ارتباط با گیرنده آنتیژن 1 بر روی سلولهای T، B و سلولهای تکهستهای دیگر نقش دارد متصل شده و مانع فرآیند دیاپدز در این سلولها از گردش خون میشود. آنتیبادی علیه Rituximab به پروتئین CD20 که بر روی سلولهای B بیان میشود، متصل گردیده و باعث کاهش قابلتوجه سلولهای B میشود. Alemtuzumab، یک آنتیبادی مونوکلونال بوده که با CD52، پروتئینی که به مقدار زیاد بر روی اکثر سلولهای B و T قرار دارد واکنش نشان میدهد. تکثیر این ویروس در این سلولها ممکن است در گردش خون
5
صورت گیرد و با ورود به سیستم گردش خون و توسط مکانیسم عدم وابستگی به لنفوسیت به سهولت وارد مغز شود. بهطور خلاصه، نتایج اخیر بیانگر، فعالیت مجدد ویروس در ناحیهای خارج از سیستم عصبی مرکزی بوده و انتقال این ویروس از سد خونی– مغزی توسط لنفوسیتها باعث ایجاد تعداد بالای مبتلایان به PML میگردد .(Brew et al , 2010)
راههای انتقال
راههای انتقال متفاوت بوده و شامل:
مدفوعی- دهانی، تنفس، تزریق خون، پیوند اعضاء، جفت و مایع منی میباشند((Bialasiewicza et al, 2008، ( Pinto and .(Dobson, 2014
اهمیت بالینی و کاربردهای ویروس
این ویروس در چندین حوزه مطالعاتی نظیر بررسی پیرامون مباحث بالینی ازجمله بیماریهای مرتبط و عوارض در ارتباط با حضور ویروس، کاربردها در علوم جدید علیالخصوص نانوتکنولوژی، شاخصهایی برای بررسیهای محیطی ازجمله میکروبیولوژی آب و پساب و بیومارکرهای زیستی برای مطالعات جمعیتی، مهاجرتی، خزانههای ژنتیکی و امنیتی از اهمیت خاصی برخوردار میباشد.
اهمیت بالینی
PML از عوارض داروهای سرکوبکننده ایمنی
علائم PML شامل اشکال در تکلم، بینایی، هماهنگی در اعمال، حافظه و یا مجموعهای از اعمال، بوده و سپس بازوها و پاها فلج شده کهاصولاً فلج یکطرفه میباشد و به مرگ بیمار منتهی میشود. افرادی که در آنها PML اثبات شودمعمولاً 1 تا 4 ماه زنده میمانند واکثراً طی 2 سال از بین میروند (Calabrese et al, 2014)، .(Hirsch et al, 2013)
تأثیر درمانهای ضد ایمنی بر رخداد PML تا سال 2005 تا وقتیکه 3 مورد در ارتباط با مصرف Natalizumab در بیماران MS و Crohn گزارش گردید بهطور عمده موردبررسی قرار نگرفته بود. پسازآن PML در 3 مورد دیگر با اختلال پسوریاز تحت درمان با Efalizumab تشخیص داده شد. این اهمیت به خاطر تأکید بر عدم مشاهده PML در ارتباط با بیماریهای MS، پسوریاز و بیماری التهاب روده بود. درنهایت Efalizumab بهصورت داوطلبانه از بازار جمعآوری گردید. Natalizumab، بهطور موقت از بازار جمع گردید؛ امابعداً مجدداً برای درمان MS و بیماری Crohn تجویز آن آغاز گردید. در سال 2006، دو مورد ابتلا به PML در ارتباط با مصرف Rituximab در بیماران لوپوس مشاهده گردید. این دارو در ارتباط با PML در مبتلایان به لنفوما نیز گزارششده است؛ که پسازآن FDA این دارو را جزء داروهای پرخطر قرارداد. همچنین داروی Mycophenolate mofetil نیز جزء داروهای پرخطر محسوب گردید زیرا در ارتباط با رخداد PML در موارد پیوند و درمان اختلالات روماتوئیدی و لوپوس بود. یک بیمار مبتلابه
6
لوپوس تحت درمان با Belimumab (یک آنتیبادی مونوکلونال که از فعالیت فاکتور فعالکننده سلولهای B جلوگیری میکند) مبتلابه PML گردید. علاوه بر این در 35 بیمار با اختلالات روماتوئیدی تحت درمان با سرکوب کنندگان ایمنی استاندارد نظیر Azathioprine، Chlorambucil، Cyclophosphamide، Methotrexate و گلوکوکورتیکوئید ها بهصورت جداگانه یا ترکیبی، PML تشخیص داده شد.
سرطانزایی
همانند آنتیژن T در SV40 آنتیژن T در ویروس JC چندین فعالیت شامل فعالیت ATP آزی، اتصال به DNA و آلفا پلیمرازی دارد که تمامی این فعالیتها برای همانندسازی DNA ضروری میباشند. علاوه بر این یافتهها مبنی بر تأثیرات متقابل پروتئینها بر یکدیگر نمایان گر ظرفیت واکنش آنتیژن T ویروس JC با چندین پروتئین سرکوبکننده تومور مانند p53 و اعضا خانواده pRb میباشد. اعتقاد بر این است که واکنش میان آنتیژن T با این سرکوبکننده ها، باعث غیرفعال کردن آنها شده و درنتیجه باعث تکثیر کنترل نشده سلول عفونی میگردد. این واکنش باعث مهار عملکرد p53 به دلیل جلوگیری از رونویسی از p21/WAF-1 که از بازدارندههای سیکلین کیناز های A و E و دیگر کینازهای مربوطه میباشد، میگردد. در شرایط عادی به دنبال کاهش فعالیت در سایکلین های G1/S؛ cdk ها به pRb متصل باقیمانده و باعث جدایی فاکتورهای رونوشت برداری فاز S نظیر E2F میشوند ولیکن بااتصال آنتیژن T به pRb فاکتور E2F از کمپلکس pRb-E2F جداشده و به E2F اجازه میدهد بر روی تکثیر سلول تأثیر گذاشته به صورتی که بهصورت مهار نشده از ژنهای فاز S رونوشت برداری کند (شکل .(4 آنتیژن T ویروس JC با دیگر پروتئینهای سلولی مانند YB-1 و Purα نیز در ارتباط میباشد. ارتباط ویروس با Purα مربوط به توانایی دگرگونی آنتیژن بوده زیرا Purα بهعنوان یک مهارکننده در چندین نوع سلول توموری مشاهده گردیده است. چپرون hsp70 و سوبسترای رسپتور انسولین-(IRS-1) 1 که از اجزا اصلی رسپتور فاکتور رشد شبه انسولینی تیپ یک (IGF-1R) میباشد نیز در ارتباط با آنتیژن T این ویروس میباشد. ارتباط میان آنتیژن T و IRS-1 بر پایهی مشارکت مسیر سیگنالینگ IGF-1 در تکثیر و بقا سل لاینهای medulloblastoma میباشد. مقدار بالای IGF-1R بیان اضافی IRS-1 و فسفریلاسیون IGF-1R و IRS-1 در رده های سلولی موشی آنتی ژن T ویروس JC، پیشنهاد کننده این موضوع هستند که ممکن است IGF-1R و آنتی ژن T در ایجاد دگرگونی در سلول با هم همکاری کنند. استفاده از روش آنتی سنس علیه IGF-1R mRNA و موتانت های غالب منفی IGF-1R در شرایط بدن موجود زنده و آزمایشگاه، نقش IGF-1R و آنتیژن T در رشد سلولهای توموری را مشخص نموده است. IRS-1 در هسته سلولهای T آنتیژن مثبت و نمونههای تومور انسانی یافت شدند که بیانگر نقش کلیدی آنتیژن T در استقرار IRS-1 میباشد. یافتهها بیانگر تعامل -N ترمینال IRS-1 و آنتیژن T ویروسJC میباشد که ایجاد جهش باعث عدم تولید سلولهای medulloblastoma تغییریافته میگردد.
تمام این مشاهدات بیانگر ارتباط میان آنتیژن T و IRS-1 بوده که با جدایی IRS-1 از IGF-1R، IRS-1 را به هسته منتقل مینماید (شکل (Khalili et al,2003) (5، .(Reiss and Khalili, 2003)
7