بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
پیوند شیمایی:
پیوند شیمیایی یعنی نزدیک شدن دو اتم به یکدیگر و همپوشانی ابرالکترونی لایه ظرفیت آنها و ایجاد ترکیبات شیمیایی
انواع پیوندها::
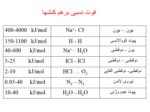
برهم کنشهای دو الکترونی : یونی.کووالانسی.کوئوردیناسیون.فلزی
نیروهای بین مولکولی:لاندن .هیدروژنی . وان در والس .یونی-دوقطبی
اسلاید 2 :
انواع پیوند ها:
- این سه نوع پیوند بر اساس اختلاف الکترونگاتیوی دوعنصرپیوندی طبقه بندی می شوند.
اسلاید 3 :
Metals
–Good conductors of heat and electricity.
–Malleable and ductile.
–Moderate to high melting points.
Nonmetals
–Nonconductors of heat and electricity.
–Brittle solids.
–Some are gases at room temperature.
اسلاید 4 :
خاصیتهای مهم اتمها در پیوند
.1شعاع اتمی ، شعاع یونی
.2الکترونگاتیوی
.3یونش و انرژی یونش
.4الکترون خواهی
اسلاید 5 :
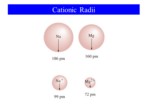
شعاع اتمی ، شعاع یونی
- با توجه به معادله شرودینگر شعاع اتمی مفهوم ریاضی ندارد!! اما...
اسلاید 6 :
شعاع واندر والس و شعاع کووالانسی
- شعاع کووالانسی نصف فاصله بین هسته ها در یک پیوند کووالانسی درون مولکولی است
- شعاع واندر والس نصف فاصله بین هسته ها در یک برهم کنش واندروالس بین مولکولی است
اسلاید 7 :
یونش و انرژی یونش
یونش یعنی جدا شدن سست ترین الکترون از اتم یا یون
یونش یعنی جهش الکترون از مداری که در آن هست، به تراز بی نهایت
یونش یعنی خارج شدن الکترون از حیطه جاذبه هسته
این عمل نیاز به مقداری انرژی دارد که به آن انرژی یونش می گویند
اسلاید 8 :
Mg(g) → Mg+(g) + e- I1 = 738 kJ
Mg+(g) → Mg2+(g) + e- I2 = 1451 kJ
اسلاید 9 :
- الکترون خواهی یعنی جذب الکترون توسط یک عنصر یا یون
- این پدیده گاه گرماگیر و گاه گرمازا است.
- انرژی الکترون خواهی مقدار انرژی است که با جذب الکترون
توسط عنصریا یون تبادل می شود.
- همانند یونش، انرژی الکترون خواهی اول، دوم، سوم و... داریم اما در عمل نمی توان تا n الکترون به اتم افزود.
- انرژی الکترون خواهی دوم همواره مثبت است.
- استثناهایی که در مورد علامت الکترون خواهی وجود دارد، به آرایش الکترونی مربوط می شود.
اسلاید 10 :
F(g) + e- → F-(g) EA = -328 kJ
F (1s22s22p5) + e- → F- (1s22s22p6)
Li(g) + e- → Li-(g) EA = -59.6 kJ