بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
فصل اول
PH سنجی
مقدمه
ا لکتروشيمي چيست؟
الکتروشيمي مبحثي در شيمي است که درمورد تبديل انرژي شيميايي به الکتريکي و بالعکس بحث مي کند.
در سلول هاي گالواني، انرژي شيميايي به الکتريکي تبديل مي شود.
در سلول هاي الکتروليز انرژي الکتريکي به شيميايي تبديل مي شود.
اسلاید 2 :
سلول شيميايي
هر سلول شيميايي در واقع يک واکنش اکسايشي - کاهشي است.
هر واکنش اکسايشي -کاهشي شامل دو نيم واکنش است.
هر نيم واکنش يک الکترود مي باشد.
نيم واکنش اکسايش، آند ونيم واکنش کاهش،کاتد نام دارد.
اسلاید 3 :
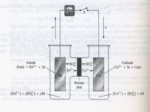
مثال در مورد يک سلول الکتروشيميايي :
يک ظرف شامل محلول سولفات مس که در آن تيغه مسي قرار دارد.
Cu2+ + 2e →Cu
يک ظرف شامل محلول سولفات روي که در آن تيغه اي از روي قرار دارد.
Z → Z 2+ + 2e
اگر ظرف ها را با پل نمکي به هم و دو تیغه را نیز بهم وصل کنيم ،
جريان برق توليد مي شود.
Cu2+ + Z → Z 2+ + Cu
اسلاید 4 :
پتانسيل سنجي pote tiometric
اندازه گيري اختلاف پتانسيل ما بين دو الکترود شناساگر و الکترود مرجع .
الکترود شناساگريا انديکاتور: پتانسيل آن وابسته به غلظت گونه در تماس با آن است. الکترود مرجع، الکترودي که پتانسيل دقيقاً معيني دارد.
اسلاید 5 :
انواع الکترودهاي مرجع
الکترود استاندارد هيدروژن - کالومل و نقره - نقره کلريد
الکترود استاندارد هيدروژن SHE
2H+ +2e H2
Pt,H2(P=1atm) H+(1M)
E=0.059 log a H+
اسلاید 6 :
الکترود کالومل
Hg Hg2Cl2(sat,d),KCl(XM)
واکنش آن؛
Hg2Cl2 +2e 2Hg +2Cl- E0=0.268
پتانسيل آن برحسب غلظت
اگر محلول کلريد پتاسيم اشباع باشد، SCE و پتانسيل آن 241/0 ولت
اسلاید 7 :
الکترودهاي فلزي
الکترودهاي غشائی
انواع الکترودهای فلزی:
الکترودهاي مرتبه يک (کاتيون ها) Ag │Ag+ (X M)
الکترودهاي مرتبه دو (آنيون ها) Ag │KCl, AgCl
الکترودهاي مرتبه سه (اکسايشي - کاهشي)
( Pt │Fe3+ (X M
اسلاید 8 :
انواع الکترودهاي غشائي :
1- الکترود شيشه PH ،
2-يون گزين (ساير کاتيونها)،
3- مايع غشائي
- 5- جامد و رسوبی
6-حساس به گاز
اسلاید 9 :
انواع روش های اندازه گيری پتانسيومتری:
1- روش مستقيم
الف)- منحنی کاليبراسيون
ب)- افزايش محلول استاندارد
2- روش غير مستقيم:
الف)- تيتراسيون های پتانسيومتری
ب)- تيتراسيون های ديفرانسيلی
اسلاید 10 :
تيتراسيون های PH- سنجی
در اين نوع تيتراسيون حجم معينی از محلول مجهول(اسيد يا باز) در بشر می ريزيم.
در داخل محلول الکترود ترکيبی PH را قرار می دهيم.
از بورت به محلول بشر قطره قطره محلول استاندارد(باز يا اسيد) اضافه می کنيم به ازاء هر افزايش محلول استاندارد، PH را می خوانيم.
از روی نمودار PH بر حسب حجم محلول استاندارد، نقطه هم ارزی تعيين می کنيم..