بخشی از مقاله
*** این فایل شامل تعدادی فرمول می باشد و در سایت قابل نمایش نیست ***
پاتوفیزیولوژی و درمان سپسیس
در ایالات متحده سپسیس عامل اصلی مرگ در بیماران شدیدا بدحال است. در هر سال ۷۵۰۰۰۰ نفر به سپسیس مبتلا می شوند که از این بین بیش از ۲۱۰۰۰۰ نفر فوت میکنند ۱۰۲. به دنبال شکست های پی در پی استفاده از داروهای ضدالتهابی در کارآزمایی های صورت گرفته بر روی بیماران دچار سپسیس محققین شک دارند که بتوان میزان مرگ و میر را به این وسیله کاهش داد. پیشرفت های صورت گرفته در روشن کردن پاتوفیزیولوژی و پایه های ژنتیکی پاسخ میزبان به سپسیس درک متداول را از این سندرم تغییر داده است و بعضی درمانها تأثیر خیره کننده ای از خود نشان داده اند. در این مقاله، ما به بررسی مفهوم کامل تر سپسیس می پردازیم و درمان های جدید و بالقوه را مورد بحث قرار می دهیم.
اختلالی در اثر التهاب کنترل نشده (افسار گسیخته)
نظریه متداول به این صورت است که سپسیس منجر به پاسخ التهابی افسار گسیخته می شود-۲۳. Lewis Thomas با بیان اظهارات زیر این تئوری را عامه پسند کرد : «میکروارگانیسم هایی که به نظر می رسد آن را به وجود می آورند تجمع میکنند و بیشتر شبیه ناظرانی از خارج هستند و این پاسخ ما به حضور آنهاست که بیماری را موجب می شود. تسلیحات ما در مقابله با باکتری ها بسیار قدرتمند هستند که حتی ما را بیشتر از مهاجمين در معرض خطر قرار داده اند . اجماع نهایی حاصل از یک کنفرانس (Consensus conference) سپسیس را بدین صورت تعریف کرده است:
سندرم پاسخ التهابی سیستمیک که در خلال عفونت رخ می دهد. کارآزمایی های بی شماری بر داروهایی که آبشار التهابی را مسدود می کنند صورت گرفته است. کورتیکواستروئیدها، آنتی بادی های ضداندوتوکسینه، آنتاگونیست های عامل نکروز دهنده تومور (TNF)۹,۱۰ ، آنتاگونیست های گیرنده اینترلوکین - ۱، و سایر داروها. عدم توفیق داروهای ضد التهابی این سؤال را برای محققین مطرح کرد که آیا مرگ در بیماران دچار سپسیس نتيجة التهاب کنترل نشده است با عوامل دیگری دخیلند . به خاطر ناهمگونی بیماران و میزان بالای سپسیس های با کشت منفی، انجام کارآزمایی های بالینی برای درمان سپسیس مشکل است. از آنجا که تحلیل نتایج منجر به post hoc stratification می شود که به صورت آینده نگر تعریف نشده است، تفسیر پیچیده می شود.
این نظریه که مرگ ناشی از سپسیس را به سیستم ایمنی شدید تحریک شده نسبت می داد، براساس مطالعات انجام شده بر جانوران مطرح شده که به نظر می رسد در ترسیم نمای بالینی در انسان ناتوان باشد ۱۸-۱۶. در این مطالعات از دوزهای بالای اندوتوکسین با باکتری استفاده می شد؛ در نتیجه، سطح گردش خون سیتوکاینها مثل عامل نکروزدهنده توموره به صورت لگاریتمی در حیوانات، در مقایسه با بیماران دچار سپسیس بالاتر بود، در این مطالعات حیوان در نتیجه طوفان سیتوکاینی می مرد و بدیهی است که عناصر و مولکول های بزرگی که این واسطه ها را مهار می کردند، بقا را بهبود می بخشیدند ۱۸-۱۶.
در بعضی از انواع سپسیس مثل مننگوکوکسمی، سطوح موجود در خون بالا و با میزان مرگ و میر مرتبط بود ۱۹٫۲۰. از ۵۵ طفلی که پورپورای شدید عفونی داشتند (۳۲ نفر با عفونت ناشی از نیسریا مننژیتیدیس)، ۹۱ درصد سطوح سرمی بالای داشتند. با این حال، مطالعات اخیر نشان داده است که فراوانی پاسخ التهابی شدید سیستمیک از آنچه که قبلا تصور می شد کمتر است ۲۴-۲۱.
Debets و همکاران تنها در ۱۱ بیمار از ۴۳ بیمار دچار سپسیس سطح قابل اندازه گیری TNF را گزارش کردند. (محدوده اندازه گیری ۵ تا ۱۰ میکروگرم در میلی لیتر) ۲. در مطالعه ای دیگر روی ۸۷ بیمار با سپسیس، کمتر از 10 درصد بیماران، TNFa یا قابل اندازه گیری داشتند .
اگرچه سیتوکاینها به عنوان متهم مطرح می شوند، ممکن است در سپسیس اثرات سودمند نیز داشته باشند. مطالعات صورت گرفته بر مدل جانوری با پریتونیت نشان داده که مهار میزان بقا را کاهش میدهد. در یک مدل نوتروپنیک سپسیس، درمان توأم علیه گیرنده های و اینترلوکین ۱ مرگبار بود. در کارآزمایی های بالینی، آنتاگونیست TNF، میزان مرگ و میر را افزایش داد. نقش در مقابله با عفونت، اخیرا با مشاهده سپسیس و سایر مشکلات عفونی در بیماران مبتلا به آرتریت روماتویید که با آنتاگویستهای TNF درمان می شدند، مورد تأکید قرار گرفته است.
مباحثه پیرامون فواید مهار سیتوکاینها در بیماران دچار سپسیس اخیرا در یک کارآزمایی که در آن درمان عليه منجر به بهبود بقا شده است، جان تازه ای گرفته است. به علاوه، تحلیل چند جانبه ای، کارآزمایی های بالینی را بر اثرات داروهای ضدالتهاب بر بیماران دچار سپسیس نشان داده که به رغم اثرات زیانبار دوزهای بالای داروهای ضد التهاب، زیرگروهی از بیماران حدودأ ۱۰٪) از این درمان سود می برند.
عمیق تر شدن درک ما از مسیرهای پیام رسانی سلولی که پاسخ به میکروب ها را میانجی گری میکنند، نشان داده که این ساده انگاری است که فکر کنیم با مهار اندوتوکسین مشکلات حاصله از سپسیس برطرف می شود. سلولهای سیستم ایمنی از طریق گیرنده های شناسایی کننده الگو (Pattern recognition receptors) موسوم به گیرنده های شبه باجگیر
اقدام به شناسایی میکروارگانیسم ها کرده، پاسخ را شروع میکند. درک نقش TLR ها در مقابله با
عفونت از طریق مطالعاتی بر موش های که در اثر جهشی در ژن4 TLR ، به اندوتوکسین مقاوم شده اند، حاصل شده است. به رغم مقاومت این موشها به اندوتوکسین، در اثر سپسیس واقعی، در آنها افزایش مرگ و میر دیده می شود. جهشهای TLR4 در انسان نیز شناخته شده است و ممکن است فرد را به عفونت حساس کند۵. بنابراین، اگرچه اندوتوکسین اثرات مضری دارد، مهار کامل آن ممکن است نامطلوب باشد. دلایل شکست آنتی بادی های مونوکلونال ضداندوتوکسین در بهبود پیش آگهی بیماران دچار سپسیس، پیچیده است.
شکست سیستم ایمنی
در بیماران دچار سپسیس، اختلالاتی همچون از دست رفتن واکنش افزایش حساسیت تأخیری، ناتوانی در پاکسازی عفونت و مستعدشدن فرد به عفونت های بیمارستانی، حکایت از سرکوب ایمنی دارد ۳۹-۳۷. یکی از دلایل شکست راهکارهای ضد التهابی در بیماران دچار سپسیس ممکن است تغییر سندرم در خلال زمان باشد. در ابتدا، سپسیس احتمالا با افزایش واسطه های التهابی مشخص می گردد؛ ولی با ادامه سپسیس، سیر بیماری به سمت وضعیتی ضدالتهابی با سرکوب ایمنی پیش می رود. مشاهدة آزاد شدن مقادیر به مراتب کمتر سیتوکاین های التهابی
و اینترلوکین از خون تحریک شده با لیپوپلی ساکارید در بیماران دچار سپسیس در مقابله با بیماران شاهد در بعضی مطالعات، از شواهد سرکوب ایمنی است. در بیماران دچار سپسیس عواقب وخیم سرکوب ایمنی ناشی از سپسیس با تجویز اینترفرون معکوس شد. این تحریک ایمنی باعث بازگشت تولید در ماکروفاژها شد و میزان بقا را بهبود بخشید.
مکانیسم های سرکوب ایمنی در سپسیس جابه جایی به سمت سیتوکاینهای ضدالتهابی
سلولهای فعال شده طوری برنامه ریزی شده اند که سیتوکاینهایی با دو اثر مجزا و خواص آنتاگونیستی ترشح کنند ۴۲٫۴۳. این سلوها یا سیتوکاینهایی با خواص التهابی سلولهای کمک کننده تیپ .ترشح میکنند مثل ، اینترو فرون و یا سیتوکاین هایی با خواص ضد التهابی (سلول های T کمک کننده تیپ .مثل و (شکل 1). فاکتورهایی که تعیین می کند سلول پاسخ داشته باشند نامعلوم هستند ولی امکان دارد نوع
پاتوژن، اندازه تلقیح باکتریال و محل عفونت در این امر دخیل باشند۴۲. سلولهای تک هسته ای بیماران دچار سوختگی یا تروما، سطوح کاهش یافته سیتوکاینهای و افزایش سطوح سیتوکاینهای 2Th یعنی دارند و دیده شده که در بیماران دچار سپسیس، معکوس کردن پاسخ ، با بهبود بقا همراه است. در سایر مطالعات نیز نشان داده شده که در بیماران دچار سپسیس سطح افزایش می یابد و سطح آن پیشگویی کنند؛ احتمال مرگ بیمار است .
انرژی
آنرژی وضعیت عدم پاسخ دهی به آنتی ژن است. وقتی سلولهای T نتوانند تکثیر پیدا کنند یا در پاسخ به آنتی ژنهای اختصاصی شان سیتوکاین ترشح کنند، آنرژی پیدا میکنند. Heidecke و همکاران، در بیماران دچار پریتونیت عملکرد سلول های T را بررسی کردند و مشاهده کردند که این سلولها بدون افزایش ترشح سیتوکاین توسط2 Th، دچار کاهش فعالیتTh1 شده اند که بر آنرژی دلالت دارد. نقص در تکثیر سلول T و ترشح سیتوکاین با میزان مرگ و میر ارتباط داشت. بیماران دچار تروما یا سوختگی، سطوح سرمی کاهش یافته سلولهای T دارند و سلولهای T باقی مانده آنها نیز آنرژی دارند.
ممکن است مرگ سلولی برنامه ریزی شده (apoptosis)، عامل انرژی حاصل از سپسیس باشد. اگرچه تصور می شد سلولها به واسطه نکروز می میرند، مطالعات جدید نشان داده که امکان مرگ سلول ها به وسیله آپوپتوزیس - مرگ سلولی برنامه ریزی شده توسط ژن - نیز وجود دارد. در آپوپتوزیس، سلولها با فعال کردن پروتئازهایی که سلول را مختل می کند، مرتکب خودکشی میشوند ۲۸۴۹. در سپسیس تعداد زیادی از لنفوسیت ها و سلول های اپیتلیوم دستگاه گوارش به واسطه آپوپتوزیس از بین می روند ۵۲ - ۵۰. مکانیسم احتمالی آپوپتوزیس لنفوسیتها، می تواند ترشح درون زاد گلوکوکورتیکوئیدها به واسطه استرس باشد. نحوه مرگ سلول، مشخص کننده فعالیت ایمنی زایی سلول های ایمنی زنده است (شکل 1). سلولهای آپوپتوزیابنده با القاء آنرژی و یا با ترشح سیتوکاینهای ضد التهابی پاسخ عليه عوامل پاتوژن را مختل می کنند و این در حالی است که سلول های نکروزشده موجب تحریک ایمنی و تقویت دفاع عليه میکروب ها می شوند. (شکل 1)
انتقال
مرگ سلول های ایمنی
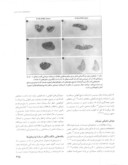
بررسی های اتوپسی بیمارانی که در اثر سپسیس فوت کرده بودند حکایت از مرگ قابل ملاحظه و پیشرونده ناشی از آپوپتوزیس سلول های سیستم ایمنی تطابقی داشت ۵۲ - ۵۰، اگرچه نابودی سلولهای ، سلول های قاتل طبیعی با ماکروفاژها دیده نشد ولی سپسیس موجب کاهش چشم گیر سلولهای (شکل ۲)، سلول های (شكل 3) و سلولهای دندریتی فولیکولر (شکل ۲) شد. نابودی لنفوسیتها و سلولهای دندریتی از آنجا حایز اهمیت است که در خلال عفونت تهدیدکننده زندگی که ازدیاد کلونی لنفوسیت ها مورد انتظار است، رخ داده است.
شدت نابودی حاصل از آپوپتوزیس لنفوسیت ها در خلال سپسیس با بررسی شمارش لنفوسیت های در گردش بیماران مشخص است. در یک مطالعه، از میان ۱۹ بیمار دچار سپسیس ۱۵ نفر شمارش مطلق لنفوسیت پایین تر از حداقل طبیعی داشتند متوسط در هر میلی متر مکعب در مقابل حداقل ۱۲۰۰ در هر میلی لیتر مکعب). نابودی سلول های B، سلول های و سلولهای دندریتی به ترتیب موجب اختلال در تولید آنتی بادی، فعال شدن ماکروفاژها و عرضه آنتی ژن می شود. اهمیت بالقوه از بین رفتن لنفوسیت ها با مطالعات صورت گرفته روی حیوانات که بهبود بقا در نتیجه ممانعت از آپوپتوزیس النفوسیت ها را نشان داده، به اثبات می رسد ۶۱-۵۸. نقایص ایمنی از جمله اختلال کارکرد مونوسیتها ,که در بیماران دچار سپسیس مشاهده می شود در جدول ۱ به نمایش در آمده اند.
.
ارزیابی تازه نظریه Lewis Thomas
محققین نظریه Lewis Thomas را که ذکر می کرد پاسخ اولیه بدن به عفونت و آسیب، التهاب بیش از حد کنترل نشده است، مورد تردید قرار داده اند. Munford و Pugin بر این عقیده اند که پاسخ طبیعی بدن به استرس، فعال شدن مکانیسم های ضدالتهابی است و در خارج از بافت های درگیر، پاسخهای سیستمیک ضدالتهابی بدن غالب هستند. آنها چنین فرض می کنند که سلول های ایمنی و سیتوکاین ها دارای نقش های آسیب رسان و محافظتی هر دو هستند که مهار این واسطه ها می تواند پیش آگهی را وخیم تر کند. Heidecke و همکاران در بیماران دچار سپسیس فعالیت سلول های T را بررسی کردند و به این نتیجه رسیدند که در آغاز سپسیس، سرکوب ایمنی مشاهده می شود که این حکایت از پاسخ ایمنی ضعیف اولیه دارد.
Weighardt و همکاران در بیمارانی که متعاقب جراحی وسیع أحشاء، دچار سپسیس شده بودند به بررسی تولید سیتوکاینها توسط مونوسیت ها در اثر تحریک یا لیپوپلی ساکارید پرداختند ۶۵. سپسیس متعاقب جراحی با شروع فوری اختلال در تولید سیتوکاین های التهابی و ضد التهابی توسط مونوسیتها همراه بود.
که بقای بیماران دچار سپسیس با بازیافت پاسخ التهابی مرتبط بود ولی با بازیافت پاسخ ضدالتهابی رابطه ای نداشت ۶۵. این محققین چنین نتیجه گیری کردند که سرکوب ایمنی در سپسیس پاسخی اولیه است نه جبرانی ۶۵. دیگران پاسخی دائمی را به سپسیس در نظر می گیرند که طی آن التهاب شديد اولیه به سرکوب ایمنی منتهی می شود ۱۴۰۳۸
عوامل ژنتیکی میزبان
بر پایه مطالعات در دوقلوهای همسان و فرزند خواندگان (adoptees) مشخص شده که فاکتورهای ژنتیکی، شاخص مهمی برای استعداد به مرگ در اثر بیماریهای عفونی هستند. بعضی از افراد در ژنهای کنترل کننده پاسخ میزبان به میکروب ها تغییراتی در یک جفت باز (پلی مورفیسم تک نوکلئوتیدی) دارند ۶۹-۶۷ تغییرات شناخته شده عبارتند از پلی مورفیسم گیرنده های TNF ، گیرنده های اینترلوکین 1، گیرنده های ها، پلی مورفیسم در ژنهای سیتوکاین می تواند تعیین کننده غلظت سیتوکاینهای التهابی و ضدالتهابی تولید شده باشد و مشخص کند که فرد در پاسخ به عفونت وضعیت بیش التهابی پیدا می کند یا كم التهابی. خطر مرگ بیماران دچار سپسیس با پلی مورفیسم ژنتیکی ارتباط داده شده است. کارآزمایی های بالینی درباره اثر پلی مورفیسم روی بیماران دچار پنومونی و سپسیس در حال انجام است. چنین پلی مورفیسم هایی احتمالا در نهایت در تعیین بیماران پرخطر برای ایجاد سپسیس و اختلال عملکرد اعضاء استفاده خواهند شد. بنابراین، در آینده پزشکان قادر خواهند بود با بهره گیری از اطلاعات ژنتیکی برای تغییر پاسخ در بیماران خاص از درمان هایی بر پایه ایمونوتراپی استفاده کنند.
یافته هایی شگفت انگیز درباره نوتروفیلها
از نوتروفیل ها به عنوان شمشیرهایی دو لبه در سپسیس یاد شده است. اگرچه تصور می شد برای ریشه کنی پاتوژنها وجود نوتروفیل ها ضروری است، ولی از طرف دیگر آزادسازی بیش از حد اکسیدان ها و پروتئازها توسط نوتروفیل ها مسئول آسیب به
ارگانها شناخته می شدند. به خاطر انبارسازی داخل ریوی نوتروفیل ها و درگیری شایع ریه به صورت سندرم زجر تنفسی حاد چنین تصور می شود که ارتباط فعال شدن بیش از حد و کنترل نشده نوتروفیلها با آسیب بافتی، به خصوص در ریه ها صادق است. با وجود اینکه یافته های حاصل از مطالعات روی حیوانات بر آسیب با واسطه نوتروفیلها دلالت می کند، مطالعات دیگر با استفاده از فاکتور تحریک کننده کولونی گرانولوسیت برای افزایش تعداد و تشدید عملکرد آنها نشان دهنده بهبود بقا در بیماران دچار سپسیس بود.
در بیماران دچار پنومونی کسب شده از بیمارستان و جامعه دو کارآزمایی بالینی روی انجام شد ۷۱٫۷۲. به رغم افزایش شمارش گلبولهای سفید تا 70/000 در هر میلی متر مکعب، در بیماران دچار پنومونی شواهدی از اثرات سوء بر کارکرد ریه دیده نشد. اگرچه با استفاده از در زیر مجموعه ای از بیماران با پنومونی مولتی لوبر مشکلات کمتر و مدت زمان بستری کوتاه تر در بخش مراقبتهای ویژه مشاهده شد، اما بهبودی در بقا مشاهده نشد. به طور مشابه، در بیماران بستری با پنومونی کسب شده از جامعه یا بیمارستان که با درمان شدند، بهبود بقا، کاهش نقص عملکرد اعضاء و کاهش روزهای بستری در بخش مراقبت های ویژه مشاهده نشد ۷۲ با وجودی که لکوسیتوز شدید حاصل از آسیب رسان نبود، لزوما از روی چنین قرائنی نمی توان نتیجه گیری کرد که در بیماران دچار سپسیس لکوسیتوز شدید مضر است. با اینحال، این در مطالعه بالینی مبین این مطلبند که بعید است مهار عملکرد نوتروفیل ها برای جلوگیری از مشکلات سپسیس سودمند باشد. به علاوه، به طور مشابه درمان هایی که به منظور افزایش تعداد یا فعالیت نوتروفیل ها در بیماران دچار سپسیس صورت گرفته نیز، مؤثر به نظر نمی رسند.
درس هایی از بررسی های کالبدشکافی
بررسی های کالبدشکافی نشان داده که در بیماران متوفی در بخش مراقبتهای ویژه، شایع ترین خطای قابل پیشگیری شکست در تشخیص و درمان مناسب عفونت ها با آنتی بیوتیکها با برقراری تخلیه جراحی است ۲۳٫۷۴. آزمایشگاه ما روی ۲۰ بیمار که در بخش مراقبت های ویژه فوت کردند، بررسی کالبدشکافی صورت داد. بلافاصله پس از مرگ هر بیمار رضایت نامه اخذ می شد، به گونه ای که معمولا در خلال ۳۰ تا ۹۰ دقیقه پس از مرگ نمونه بافتی گرفته می شد که موجب شد قبل از وقوع تغییرات لیز خود به خودی ریخت شناسی بافت انجام شود. به علاوه در گروهی شاهد مشتمل بر متوفیانی که به شدت بیمار بودند و سپسیس بالینی نداشتند نیز کالبدشکافی انجام شد. تحلیل ایمنی بافتی شیمیایی (immunohistochemistry) مؤید این مطلب بود که در اکثریت بیماران دچار سپسیس تنها دو نوع سلول - لنفوسیتها و سلول های اپیتلیوم دستگاه گوارش - در حال زوال بودند که این یافته با یافته های حاصل از مطالعات روی حیوانات مطابقت دارد ۳۹ . ۵۴٫۷۵. همانگونه که قبلا ذکر شد انهدام بارز سلولهای سیستم ایمنی تطابقی (adoptive) نیز وجود داشت. لنفوسیتها و سلول های اپیتلیوم دستگاه گوارش به طور عادی به علت آپوپتوزیس، بازچینی (turnover) سریعی دارند و احتمالا سپسیس این فرایندهای فیزیولوژیک را تسریع می کند. در هر ۷ نفر از ۲۰ بیمار، نکروز موضعی هپاتوسیتها در ناحیه ورید مرکزی (احتمالا به علت آسیب پذیری این ناحیه به هیپوکسی) و در ۳ بیمار شواهدی به نفع انفارکتوس مغز و قلب قبل از مرگ دیده شد.
4 ht
خفتگی (hibernation) سلولی به عنوان مکانیسمی برای نقص عملکرد عضو
یافته شگفت انگیز دیگر در بررسی های کالبدشکافی عدم تناسب بافت شناسی با درجه نقص عملکرد عضو در بیمارانی که در اثر سپسیس فوت کرده اند بود. مرگ سلولی در قلب، کلیه، کبد و ریه نسبتا جزیی بود و مطرح کننده شواهد بیشتر نقص عملکرد عضو نبود. در بیماران دچار سپسیس که دپرسیون میوکارد داشتند شواهدی از آسیب به میوسیت های قلب دیده نمی شد. (در هیچ یک از بیماران، منگو کو کسی که موجب میوکاردیت با ارتشاح ارگانیسم ها و گرانولوسیتها می شود، دیده نشد). نمای بافت شناسی در بیمارانی که سپسیس و نارسایی حاد کلیه داشتند تنها نشان دهنده آسیب کانونی بود و گلومرولها نرمال و توبولهای کلیه سالم بودند. این یافته ها مشابه یافته های مطالعات روی بیماران دچار نارسایی حاد کلیه است که در آنها در بررسی های میکروسکوپی عدم تناسب بین درجه نکروز توبولی و سطح نقص عملکرد کلیه دیده می شود ۷۶۷۷. اکثر بیماران دچار سپسیس و نارسایی حاد کلیه که زنده می مانند، عملکرد پایه کلیوی را حفظ می کنند که این امر نشان دهنده آن است که در حین سپسیس مرگ سلولهای کلیوی بیش از حد نیست ۷۸.
ما گمان میکنیم در بیماران دچار سپسیس قسمت اعظم نقص عملکرد اعضاء را بتوان با خفتگی سلولی یا گیجی سلولی (cell stunning) که در خلال ایسکمی میوکارد نیز رخ می دهد توجیه کرد ۷۹. احتمالا، سپسیس با فعال کردن مکانیسم های دفاعی موجب تنزل فرایندهای سلولی به وظایف خانه داری (housekeeping tasks) می شود. تحقیق صورت گرفته توسط آزمایشگاه Fink و همکاران مطرح کننده پایه مولکولی احتمالی گیجی سلولی است که نشان داده است که سلول های روده ای (enterocyte) تحریک شده از راه ایمنی (immunostimolated) در نتیجه تخلیه نیکوتینامید آدنین دی نوکلئوتاید ثانویه به فعال شدن آنزیم هسته ای (poly adensine diphosphate ( ADP
، ribose polymerase توسط peroximitrite یا سایر اکسیدان ها، کاهش مصرف اکسیژن پیدا می کنند.
مرگ بیماران دچار سپسیس
در هیچکدام از مطالعات کالبدشکافی علت مرگ بیماران دچار سپسیس مشخص نشده است. به ندرت، ممکن است بیمار دچار سپسیس در اثر شوک مقاوم به درمان فوت کند ولی این امر استثناء است. به رغم دپرسیون مفرط میوکارد در بیماران دچار سپسیس، معمولا در نتیجه اتساع قلب و تاکیکاردی، برونده قلبی حفظ می شود. به رغم بروز شایع سندرم زجر تنفسی حاد، این
بیماران به ندرت در اثر هیپوکسی یا هیپرکاربیا فوت می کنند . نارسایی کلیه نیز شایع است ولی به خاطر امکان استفاده از دیالیز، به تنهایی مرگبار نیست. به ندرت نقص عملکرد کبد به سمت آنسفالوپاتی کبدی پیشرفت می کند. بنابراین علت دقیق مرگ در بیماران دچار سپسیس امری ناشناخته باقی مانده است. وقتی خانواده بیماران به دنبال مشاوره با پزشکان ادامه درمان را بی نتیجه تصور میکنند با قطع و عدم ادامه درمان نگهداری، اکثر بیماران فوت میکنند.
مفاهیم جدید در درمان سپسیس
پزشکان معالج بیماران بخش های مراقبتهای ویژه به دانشی کامل از علل شایع عفونی و غیر عفونی تب در این جمعیت بیماران نیاز دارند (جدول ۲). در بسیاری از بیمارانی که به سپسیس دچار می شوند مثل بیماران پیر و بیماران اور میک تب دیده نمی شود. در بیماران دچار سپسیس فقدان پاسخ فاز حاد واضح، با میزان مرگ و میر بالا همراه است و منعکس کننده فاز سرکوب ایمنی سپسیس است. از یافته های زودرس سپسیس می توان به تغییرات جزیی وضعیت شعوری، افزایش یا کاهش جزیی شمار گلبول های سفید با درصد نوتروفیل ها با افزایش سطوح قند خون اشاره کرد. شناسایی سریع سپسیس کلید درمان موفقیت آمیز است.
پروتئین C و فعال شده
پروتئین C فعال شده انسانی نو ترکیب، که عامل ضدانعقاد است، اولین داروی ضدالتهابی است که ثابت شده در درمان سپسیس مؤثر است ۸۴۰۸. در بیماران دچار سپسیس، تجویز پروتئین C فعال شده منجر به کاهش خطر نسبی مرگ و کاهش خطر مطلق مرگ شد ۸۴. پروتئین C فعال شده با غیرفعال کردن فاکتورهای Va و VIIIa از ایجاد ترومبین ممانعت میکند که تأثیر داروهای ضد انعقاد در بیماران دچار سپسیس به بازخورد (feedback) بین سیستم انعقادی و آبشار التهابی نسبت داده شده است. مهار تولید ترومبین توسط پروتئین C فعال شده با مهار فعالیت پلاکتی، مهار به کارگیری نوتروفیل ها و مهار دگرانولاسیون ماست سلها التهاب را کاهش می دهد. پروتئین C فعال شده خواص مستقيم ضد التهابی مثل مهار تولید سیتوکاینها توسط مونوسیت ها و مهار چسبندگی سلولی دارد.
اینکه چرا پروتئین C فعال شده با موفقیت استفاده شده ولی دو ضدانعقاد دیگر به آنتی ترومبین III و مهارکننده مسیر فاکتور بافتی - در درمان سپسیس توفیقی به دست نیاوردند هنوز به صورت معما باقی مانده است. پاسخ احتمالی به شکست این دو عامل ضد انعقاد أن است که این عوامل بر محل های متفاوتی از آبشار انعقادی تأثیر می گذارند. به علاوه، فاکتور C فعال شده خواص ضد آپوپتوزیس دارد که می تواند در تأثیرات آن نقش داشته باشد ۸۷.
در مقالات اخیر بحث درباره استفاده مناسب از پروتئین C فعال شده و همین طور عوارض جانبی احتمالی مطرح شده است ۹۰-۸۹ .ریسک اصلی در اثر درمان با پروتئین C فعال شده، خونریزی است. در مطالعه ای روی پروتئین C فعال شده، بیماران در مقایسه با ۲ %بیماران که دارونما (Placeho) دریافت کرده بودند دچار خونریزی مخاطره آمیز شدند
(خونریزی داخل مغزی، اپیزود خونریزی تهدیدکننده زندگی، یا نیاز به سه واحد خون یا بیشتر). با استفاده openlabel پروتئین C فعال شده پس از کارآزمایی، ۱۳ بیمار از ۵۲۰ بیمار به خونریزی داخل مغزی دچار شدند. در بیمارانی با نسبت نرمال شده بین المللی (INR) بیش از ۳ یا شمارش پلاکت کمتر از 30/000 در میلی متر مکعب در استفاده از پروتین و فعال شده باید احتیاط کرد، در حال حاضر، استفاده از پروتئین C فعال شده تنها در بیماران دچار سپسیس با شدیدترین درگیری اعضاء و بیشترین احتمال مرگ مورد تأیید قرار گرفته است. در بسیاری از بیمارستان ها استفاده ازپروتئین C فعال شده تنها به بیماراتی بدحال تر که کرایتریای سیستم امتیازدهی
Evaluation Acute Physiology & Chronic Health
(APACHEII را برآورده می کنند، محدود می شود.
درمان شدید با انسولین برای هیپرگلیسمی
Van den Berghe و همکاران نشان داده اند که درمان شدید با انسولین که قند خون را بین ۸۰ تا ۱۱۰ میلی گرم در دسی لیتر حفظ کند در مقایسه با درمان مرسوم که قند خون را بین ۱۸۰ تا ۲۰۰ میلی گرم در دسی لیتر حفظ می کند
در بیماران بسیار ناتوان مرگ و میر و عوارض را کاهش داده است . درمان شدید با انسولین فراوانی اپیزودهای سپسیس را به میزان ۴۶٪ کاهش داد. بیماران دچار باکتریمی که با درمان شديد انسولین درمان شدند در مقایسه با بیمارانی که با درمان مرسوم درمان شده بودند، میزان مرگ و میر کمتری داشتند
. بدون در نظر گرفتن سابقه قبلی دیابت، درمان با انسولین میزان مرگ ناشی از نارسایی چندارگان را نزد بیماران مبتلا به سپسیس کاهش داده است.
مکانیسم محافظتی انسولین در سپسیس ناشناخته مانده است. فرآیند بیگانه خواری نوتروفیل ها در بیماران دچار هیپرگلیسمی مختل می شود و اصلاح هیپرگلیسمی ممکن است خواص بیگانه خواری باکتری ها را بهبود بخشد مکانیسم احتمالی دیگراثرات ضد آپوپتوزیس انسولین است؟
. انسولین با فعال کردن مسير مانع مرگ آپوپتوتیک سلول های ناشی از تحریک متعدد می شود . بدون در نظر گرفتن مکانیسم، کنترل شدیدتر گلوکز خون در بیماران شدید ناتوان معقول به نظر می رسد. در تلاش برای نگاه داشتن سطوح گلوکز خون بین ۸۰ تا ۱۱۰ میلی گرم در دسی لیتر پزشکان باید از آسیب هیپوگلیسمیک