بخشی از مقاله
کنترل بيولوژيکي دوجدايه مخمراز Saccharomyces cerevisiae عليه بيماري کپک آبي سيب (Penicillium expansum) در جهت کاهش آلودگي زيست محيطي
چکيده
سابقه و هدف : در دهه هاي اخير باقيماندة سموم بر روي ميوه ها باعث ايجاد نگراني هايي در جوامع علمي شده است . درحال حاضر کنترل بيولوژيک به عنوان يک روش جايگزين استفاده از سموم مطرح شده است و موفقيت هاي چشمگيري در زمينه استفاده از ميکروارگانيسم هاي آنتاگونيست براي کنترل بيماري هاي بعد از برداشت (از جمله کپک آبي سيب ) به دست آمده است .
مواد و روش ها: در اين مطالعه تحقيقاتي (original) دو گونه از مخمر Saccharomyces cerevisiae (٦٩، ٠٤) به جاي قارچ کش هاي معمولي که براي کنترل بيماري انباري کپک آبي سيب مورد با عامل Penicillium expansum مورد استفاده قرار مي گيرند، به کار گرفته شد. عامل کپک آبي سيب از بافت آلودة سيب جداسازي شد. آزمون تست تقابل ، متابوليت هاي خارج سلولي و مواد فرار در آزمايشگاه براي ارزيابي قدرت بيوکنترلي مخمرها به کار برده شد. در آزمايش هاي انباري زخم هاي ايجاد شده بر روي سيب با μl٤٠ ميکروليتر سوسپانسيون مخمر آنتاگونيست (١٠٧ کنيدي در ميلي ليتر) و ٢٤ ساعت بعد ٢٠ ميکروليتر سوسپانسيون قارچ عامل بيماري (١٠٥ کنيدي در ميلي ليتر) مايه زني شد. سيب هاي مايه زني شده در C°٢٠ و C°٥در انبار قرار گرفتند. اين مقاله برگرفته از پايان نامه دانشجويي مي باشد.
يافته ها: همه جدايه ها رشد قارچ P.expansum هم در آزمايشگاه و هم در انبار را کاهش دادند. درآزمون کشت متقابل ميزان کاهش رشد بين ٣٣.١٢ تا ٥٨.٤، در مورد گاز فرار ٥٤.٩٣ تا ٧٢.٨٧ و در تست متابوليت هاي خارج سلولي بين ٥٠.٢٣ تا ٧٦.٢٣ متغيير بود. هر دو جدايه مخمر مساحت لکه ها را کاهش دادند. در تست هاي انباري مساحت لکه ها در روي سيب در C°٥ از ١٤١٦تا ١٤٣٥ميلي مترمربع در مقايسه با ٣١٥١.١ ميلي مترمربع ، در شاهد کاهش نشان دادند. در دماي C°٢٠ مساحت لکه از ١٣٤٧ تا ١٥٩٨متغيير بود در حالي که ميانگين مساحت در شاهد ٣٢٥٧.٤ ميلي متر بود.
نتيجه گيري : هر دو ايزوله از مخمر S. cerevisiae عليه کپک آبي سيب در هر دو دما موثر بودند و مي توانند به عنوان دوعامل بيوکنترل جديد کپک آبي سيب به کار برده شوند.
مقدمه
يکي از مناطق عمده توليد اين محصول در شمال غرب ايران واقع سيب يکي از مهم ترين محصولات کشاورزي در دنيا و ايران است . شده است . نظر به استفاده از سيب در تمام سال نياز اين محصول به انبارداري امري اجتناب ناپذير است .
با وجود امکانات و تجهيزات پيشرفته انبارداري خسارات بعد از برداشت ميوه ها و سبزيجات در حدود ٤٠ –١٠ درصد ارزيابي شده است (١). مهمترين قارچ هايي که در انبار به سيب خسارت مي زنند Penicillium expansum: Link عامل کپک آبي سيب ، .Botrytis cinerea Pers: Fr عامل کپک خاکستري سيب و قارچ هاي ديگري نظير .Alternaria sp مي توان نام برد (٢).
از موثرترين راه ها براي کنترل بيماري هاي بعد از برداشت استفاده از قارچ کش ها از جمله تيابندازول است ، اما به دليل به مخاطره افتادن سلامت انسان از يک طرف و مقاومت قارچ ها به سموم از طرف ديگر ضرورت دستيابي به روش هاي جايگزين براي کنترل شيميايي را طلب مي کند (٣).
درحال حاضر افزايش نگراني ها را در مورد به مخاطره افتادن سلامت انسان ناشي از باقيماندة سموم بر روي محصولات انباري از يک طرف ، افزايش مقاومت قارچ ها ناشي از استفادة روز افزون قارچ کُش ها از طرف ديگر دانشمندان را به فکر استفاده روش هاي جايگزين از قارچ کش انداخته است (٤).اين مواد شيميايي علاوه بر اين که بر روي ميوه باعث ايجاد بيماري هاي خطرناک از جمله سرطان در انسان مي شوند، باقيمانده هاي به دليل دير تجزيه شدن آن ها ممکن است وارد ذخاير آب زير زميني و باعث آلودگي آب هاي زير زميني شود. در نتيجه کنترل بيولوژيک با استفاده از ميکروارگانيسم هاي آنتاگونيست به عنوان يک روش جايگزين اميدبخش پيشنهاد شد.
در ميان روش هاي مختلف پيشنهادي کنترل بيولوژيک از موفقيت نسبي بيشتري برخوردار شد. اين روش به تنهايي و يا بخشي از روش هاي کنترل بيماري هاي بعد از برداشت مورد بررسي قرار گرفت (٥).
در اين بررسي دو جدايه از مخمر Saccharomyces cerevisiae از پژوهشکده بيوتکنولوژي کرج دريافت شد. يک جدايه از قارچ Penicilliumexpansumهم از سطح سيب هاي آلوده جداسازي گرديد و بر اساس خصوصيات مورفولوژيکي شناسايي گرديد.
جدايه هاي مخمر در کنترل قارچ عامل بيماري کپک آبي سيب (P.expansum) در شرايط آزمايشگاه و در شرايط انبار روي ميوه سيب مورد بررسي قرار گرفتند.
مواد و روش ها
مطالعه حاضر يک مطالعه تحقيقاتي (original) مي باشد.
عامل بيماري : قارچ عامل بيماري (Penicillium expansum) از ميوه آلوده سيب سردخانه مهرشهر کرج جدا و خالص سازي گرديد. اين جدايه قارچي روي محيط (PDA)Potato Dextrose Agar در دماي C°٤ نگهداري و هر چند وقت يک بار جهت حفظ خصوصيات فيزيولوژيکي وبيماريزايي به سيب مايه زني شده وازآن جدا شد (٦).
آنتاگونيست : دوجدايه از مخمر S. cerevisiae از پژوهشکده بيوتکنولوژي کرج دريافت شد.
تهيه سوسپانسيون قارچ عامل بيماري : سوسپانسيون قارچ عامل بيماري از کشت ٧ تا ١٠ روزه روي محيط کشت PDA تهيه شد.
به اين ترتيب که با يک لوپ مقداري از اسپور قارچ عامل بيماري برداشته شد و سپس در ١٠ ميلي ليتر آب مقطر استريل حاوي ٠.٠٥% (حجم به حجم ) تويين ٢٠ غوطه ور گرديد. از سوسپانسيون حاصل جهت تهيه غلظت مورد نياز استفاده شد. غلظت مورد نياز (١٠٥×١کنيدي در هر ميلي ليتر) با استفاده از لام هماسيتومتر و افزودن آب مقطر استريل به دست آمد (٧).
تهيه سوسپانسيون آنتاگونيست : در هر ارلن ماير ٢٥٠ ميلي ليتري ٥٠ ميلي ليتر از محيط (NYDA)NutrientYeast DextroseAgar ريخته و در دماي ١٢١ درجه سانتي گراد و فشار ١.٥ اتمسفر استريل شد. پس از سرد شدن محيط به هر ارلن ماير يک لوپ از سلول هاي مخمر افزوده شد. سپس ارلن مايرها روي شيکر با ٢٠٠ دور در دقيقه به ِ مدت ٤٨ ساعت در دماي اتاق قرار گرفتند. سپس سلول هاي مخمر با سانتريفيوژ g × ٣٠٠٠ به مدت ١٠ دقيقه از محيط مايع جدا شده و دو بار با آب مقطر استريل شستشو داده شدند (٨). پس از آن با استفاده از لام هماسيتومترسوسپانسيون آنتاگونيست در غلظت هاي مورد نظر (١٠٥، ١٠٦، ١٠٧، ١٠٨ سلول در ميلي ليتر) تهيه گرديد.
سيب : سيب هاي مورد استفاده در اين بررسي سيب هاي زرد رقم ُگلدن دليشز بودند که از باغات دماوند تهيه شده بود. پس از شست و شوي سيب ها با آب ، سيب ها به مدت ١ دقيقه در محلول هيپوکلريت سديم ٠.١% تجاري قرار داده و سپس به مدت ٣٠ ثانيه در اتانول ٩٥% شسته شده و سرانجام سه بار با آب مقطراستريل آب کشيده شدند. سپس بر روي هر سيب سه چاهک به فواصل مساوي با ميخ استريل به قطر mm ٢.٥وبه عمق 3mm زده شد (٩).
اثر ايزوله هاي S. cerevisiae روي قارچ expansum در شرايط آزمايشگاه
آزمون کشت متقابل (Dual culture)
اين آزمون بر اساس روش Dennis and Webster (١٩٧١) انجام شد (١٠). ابتدا هر پتري به کمک ماژيک به دو قسمت مساوي تقسيم شد سپس درون هر تشتک پتري به ميزان ١٥ ميلي ليتر از محيط کشت PDA ريخته شد. پس از جامد شدن محيط در يک نيمه ازتشتک پتري در فاصله يک سانتي متري از لبه آن پلاکي از محيط کشت جوان قارچ بيمارگر (٢روزه روي WA) قرار داده شد. جدايه هاي مخمر در محيط NYDB کشت داده شده و به مدت ٢٤ ساعت روي شيکر با ٢٥٠ دور در دقيقه قرار گرفت . سپس ٤٨ ساعت بعد از گذاشتن پلاگ قارچ عامل بيماري ، به کمک لوپ استريل نيمي از سطح محيط کشت به سوسپانسيون هر کدام از جدايه هاي مخمر آغشته گرديد. براي شاهد به جاي سوسپانسيون مخمر از آب مقطر استريل استفاده گرديد. پتري ها به مدت ١٨ روز در دماي ٢٥ درجه سانتي گراد در داخل انکوباتور قرار داده شدند. سپس قطر کلوني جدايه هاي قارچ اندازه گيري شده و مساحت آنها محاسبه شد. پس از اينکه در تيمار شاهد قارچ به خط وسط پتري رسيد، ميزان رشد شعاعي جداية قارچ اندازه گيري و سپس مساحت کلوني قارچي محاسبه شد و در نهايت درصد کاهش رشد مسيليوم قارچ با استفاده از فرمول زير محاسبه شد (١١).
n = (a – b) .a×100
n = درصد بازدارنگي از رشد عامل بيماري
a = مساحت کلوني عامل بيماري در پتري شاهد
b= مساحت کلوني عامل بيماري در پتري تيمار
آزمون توليد مواد فرار ضد قارچي توسط جدايه هاي آنتاگونيست
اين آزمون مطابق روش ليلبرو (٢٠٠٥) Lillbro انجام شد (١٢). دو لوپ از سوسپانسيون سلول هاي مخمر در محيط NYDB از کشت ٢٤ ساعته در روي محيط -MEA-Malt ExtractAgar کامل پخش شد.
سپس در پتري ديگر حاوي محيط PDA پلاگي از قارچ (محيط سال هفتم شماره ٣ پاييز ١٣٨٨ شماره مسلسل ٢٧ کشت ٦ روزه ) به قطر ١ سانتي متر در وسط اين محيط کشت قرار داده شد. سپس در کنار شعله و در شرايط استريل تشتک هاي حاوي قارچ عامل بيمارگر و مخمر روي هم قرار داده شد و لبه هاي آنها به کمک پارافيلم کامل پوشانيده بعد از ٢٥ روز قطر کلوني هاي قارچ اندازه گيري و سپس مساحت آنها محاسبه گرديد و طبق فرمول ذکر شده در بند ٢-٦-١ درصد کاهش رشد ميسيليومي قارچ به دست آمد.
آزمون توليد آنتي بيوتيک توسط جدايه هاي آنتاگونيست
اين آزمون مطابق روش Weller (١٩٨٨) انجام شد (١٣). ابتدا سوسپانسيون جدايه هاي آنتاگونيست که در محيط NYDB به روش گفته شده تهيه شده بودند در روي محيط PDA به صورت يکنواخت کشت داده شدند. سپس پتري ها به مدت ٩٦ ساعت در انکوباتور با دماي °C ١±٢٥ قرار گرفتند. بعد از اين مدت در شرايط استريل زير هود، کلوني هاي مخمر با کمک پنبه استريل از سطح محيط پاک شدند. سپس پتري ها وارونه شده و يک پنبه آغشته به کلروفرم در درون پتري و بر روي درب آن قرار داده شد تا باقيمانده هاي مخمر نيز در معرض بخار کلروفرم قرار گيرند و به طور کامل کشته شوند. بعد از مدت ٢٥ دقيقه درب پتري ها را به صورت نيمه باز کرده تا بخار کلروفرم به طور کلي خارج شود. سپس يک پلاگ ازکشت ٤٨ ساعته قارچ عامل بيماري در وسط پتري ها قرار داده شد اين پلاگ به منظور جلوگيري از پخش شدن اسپور از روي محيط WA برداشته شد. در پتري شاهد نيز به جاي جدايه مخمر از آب مقطر استريل استفاده شد. بعد از ١٨ روز قطر کلوني قارچ اندازه گيري شد.وطبق فرمول موجود در بند ٢-٦-١ درصد کاهش رشد محاسبه گرديد. اين آزمون ها هر کدام به صورت جداگانه در قالب يک طرح کاملاً تصادفي و با ٤ تکرار انجام شد.
بررســي اثر آنتاگونيســتي جدايه هاي مخمر در شرايط دمايي C°٢٠ و C°٥سيب ها ابتدا کامل با آب شسته شدند و بعد همان طور که در بند ٢-٥ توضيح داده شده است ابتدا ضد عفوني و سپس سوراخ شدند. پس از اين مرحله ٤٠ ميکروليتر از سوسپانسيون مخمر (تهيه شده با توجه به بند٢-٤) با غلظت ميلي ليتر CFU .٧+١٠×١، به هر چاهک از سيب تلقيح شد. سپس سيب ها هر کدام داخل يک ظرف يک بار مصرف گذاشته شده و در نهايت با خود ظرف داخل يک کيسه پلاستيکي گذاشته شدند. جهت حفظ رطوبت و جلوگيري از خشک شدن سيب ها با آب استريل در درون کيسه ها اسپري شد ورطوبت نسبي درون کيسه ها در سطح بالايي (حدود ٩٥ درصد) نگه داشته شد.
در اين آزمايش ما دو تيمار مخمر (دوايزوله مخمر) و يک شاهد داريم . به ازاي هر تيمار ٤ سيب را مورد آزمايش قرار مي دهيم در نتيجه حجم نمونه هاي مورد آزمايش قرار گرفته در هر دما ٨ عدد سيب مي باشد و ٤ عدد سيب هم مربوط به شاهد مي باشد.
پس از ٢٤ ساعت ٢٠ ميکروليتر از سوسپانسيون اسپور قارچي (تهيه شده با توجه به بند٢-٣) به داخل چاهک هاي تيمار شده با سوسپانسيون مخمري تلقيح شد. وسپس سيب ها با پلاستيک و حفظ رطوبت لازم به انبارهاي موردنظر و با دماي مشخص انتقال داده شدند.زخم هاي مايه کوبي نشده ،باآب مقطراستريل تيمارشدند (٦). سيب ها در دماي ١±٢٠ و ٥درجه سانتي گراد نگهداري شدند.
سيب ها به مدت ١٥ روز در دماي C°20 نگهداري شدند و هر ٨ روز يک بار قطر لکه ها، همچنين جمعيت قارچ و جمعيت مخمر اندازه گيري مي شد.
در دماي C°5 نيز سيب ها به مدت ٣٢ روز نگهداري شدند و هر ١٠ روز يک بار قطر لکه ها، همچنين جمعيت قارچ و جمعيت مخمر اندازه گيري مي شد.
بررســي اثر آنتاگونيستي غلظت هاي مختلف جدايه هاي مخمر (١٠٥، ١٠٦، ١٠٧ و ١٠٨) در کنترل بيماري کپک آبي ســيب در شرايط دمايي C°20 در اين آزمايش در چاهک هاي ايجاد شده بر روي سيب ها ابتدا μL ٤٠ از سوسپانسيون مخمري مانند آنچه که در بند ٢-٤ شرح داده شد تهيه شد، با اين تفاوت که غلظت هاي مختلف ١٠٥، ١٠٦، ١٠٧و١٠٨ سلول در ميلي ليتر به دست آمد. هر دو ايزولة مخمري در اين آزمايش مورد استفاده قرار گرفتند. غلظت هاي مذکور به داخل هر چاهک مايه زني شد، ٢٤ ساعت بعد 20μL سوسپانسيون ١٠٥ اسپور در هر ميلي ليتر در داخل هر چاهک مايه زني شد و مانند بند ٢-٧ سيب ها در ظروف پلاستيکي قرار داده شدند و سپس در دماي ٢٠ درجه سانتي گراد نگهداري شدند، در اين آزمايش ما دو
185 جدايه مخمري و چهار غلظت مخمر و يک تيمار شاهد داريم در نتيجه حجم نمونه هاي مورد آزمايش ٣٦، ١٦ عدد براي هر تيمار و ٤ عدد سيب مربوط به شاهد مي باشد (١٣).
تعيين جمعيت مخمر وقارچ
اين آزمايش طبق روش (٢٠٠١) .Nunes et al با کمي تغيير انجام شد (١٢). اين آزمايش فقط در مورد جدايه مخمري ٦٩ انجام گرفت .
در اين جا از محل زخم ها توسط چوب پنبه سوراخ کن و به کمک اسکالپل قطعاتي به وزن ١ گرم بيرون آورده شد و در ميلي ليتر ٩ آب مقطر استريل قرار داده شد به مدت ٢-١ دقيقه ورتکس شد تا کامل مخلوط شود سپس از اين سوسپانسيون تا رقت ٦-١٠ تهيه شد در همه اين رقت ها لوله ها با استفاده از دستگاه ورتکس به طور کامل همگن شدند.سپس μL ٢٠٠ از اين سوسپانسيون ها بر روي محيط PDA ريخته شد و پس از ٤٨ ساعت ت عداد کلوني هاي مخمر با دستگاه کلني کانتر مورد شمارش قرار گرفت . براي هر تيمار (رقت ) ٤ تکرار در نظر گرفته شد (٣).
يافته ها
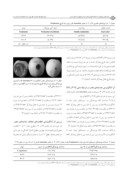
اثر ايزوله هاي S. cerevisiae روي قارچ بيمارگر درشــرايط آزمايشگاه نتايج آزمون کشت متقابل نشان داد که هر دو ايزوله مخمري نسبت به شاهد (آب مقطر استريل ) باعث کاهش رشد ميسيليوم قارچ شدند و در نتيجه اثر بازدارندگي بر روي قارچ بيمارگر داشتند. در اين آزمون ايزوله ٦٩، ٥٨.٤ درصد و ايزوله ي ٠٤، ٣٣.١٢ درصد رشد ميسيليوم قارچ بيمارگر را کاهش داد.(شکل ١) در آزمون توليد مواد
شکل ١- اثر آنتاگونيست ٦٩ Saccharomyces cerevisiae در آزمون کشت متقابل در تقابل با پاتوژن P١١
ايزوله هاي ٦٩ و ٠٤مربوط به مخمر S. cerevisiae و P قارچ بيمارگر P.expansum است فرار ايزوله ٦٩ با ٥٤.٩٣ درصد و ايزوله ٠٤ با ٧٢.٨٧ درصد باعث کاهش رشد قارچ بيمارگر شدند و هر دو ايزوله نسبت به شاهد تفاوت معني دار از خود نشان دادند. در آزمون توليد آنتي بيوتيک نيز همه ايزوله ها با شاهد تفاوت معني دار داشتند. در اين آزمون ايزوله ٦٩، ٧٦.٢٣ درصد و ايزوله ي ٠٤، ٥٠.٢٣ درصد کنترل کنندگي بر روي قارچ عامل بيمارگر داشتند. (جدول ١)
اثر آنتاگونيستي جدايه هاي مخمر در شرايط دمايي C°20 و C°5
هر دو جدايه ٦٩ و ٠٤ مربوط به مخمر S. cerevisiae در کنترل کپک آبي سيب در هر دو دماي C°20 و C°5 مؤثر بود.
در C°20 مساحت لکه پوسيدگي در سيب هاي تيمار شده با آنتاگونيست ٦٩ هشت روز پس از مايه زني با عامل بيمارگر mm2
٧٦٦.١٧ در مقايسه با mm2 ١٧٨١.٤٢ در شاهد و پس از پانزده روز mm2 ١٣٤٧.٢ در مقايسه با mm2 ٣٢٥٧.٤٤در شاهد بود. در مورد ٠٤ هشت روز پس از مايه زني با عامل بيمارگر mm٢ ٨٥٢.٠٧ در مقايسه با mm2 ١٧٨١.٤٢ در شاهد و پس از پانزده روز mm2 ١٥٩٨.٩ در مقايسه با mm2 ٣٢٥٧.٤٤در شاهد بود (شکل ٢)، (جدول ٢).