بخشی از پاورپوینت
--- پاورپوینت شامل تصاویر میباشد ----
اسلاید 1 :
در سال 1916 لوئیس و لانگ میر و کسل
نداشتن میل ترکیبی گاز های نادر را باید در آرایش الکترونی
آنها جستجو کرد
میل ترکیبی سایر اتم ها ، تمایل این اتم ها برای
رسیدن به آرایش الکترونی گاز نادر(اکتت)
اسلاید 2 :
انرژی تفکیک پيوند (D)
تفکیک مولکول گازی شکل به اتم های گازی شکل
Cl2 : Cl2(g) ® 2Cl(g).
تفکیک مولکول های چند اتمی ممکن است سبب شکستن مولکول و تبدیل ان به یک اتم و یا یک گروه از اتم ها(رادیکال ها) می شود.
CH4(g) ® C(g) + 4H(g) DH = 1660 kJ
D(C-H) = ¼DH = ¼(1660 kJ) = 415 kJ
اسلاید 3 :
انرژی تفکیک پیوند به نوع اتم های موجود در مولکول بستگی دارد.
انرژی پیوند به خواص دو اتم پیوند یافته بستگی دارد و در مولکول های مختلف تقریبا یکسان است.
مثلا انرژی پیوند c-c در nپروپان و nپنتان یکسان است.
و به اتم های اطراف وابستگی کمتری دارد.
CH3-CH2-CH3
CH3-CH2-CH2-CH2-CH3
انرژی متوسط پیوند
انرژی تفکیک پیوند انرژی لازم برای شکستن یک پیوند معین در یک مولکول معین می باشد.
انرژی متوسط پیوند(E) مقدار متوسط انرژی لازم برای شکستن یک پیوند معین در هر ترکیبی که این پیوند باشد.
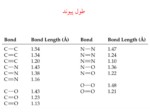
طول پیوند
فاصله بین هیچ دو اتمی مقدار ثابت و مشخصی نیست.
فاصله متوسط بین هسته اتم های پیوند یافته را طول پیوند یا فاصله پیوند گویند.
از طریق پراش(دیفراکسیون) پرتو ایکس و طیف های مولکولی ، طول پیوند قابل محاسبه است.
اسلاید 4 :
الكترونگاتيوي و طول پيوند
جدول2-2 صفحه 71
HI>HBr>HCl>HF
I2>Br2>CL2>F2
پیوند های سه گانه نسبت به دوگانه و یگانه کوتاه ترند
هرچه اتم متصل الکترونگاتیوتر باشد طول پیوند کمتر است
اسلاید 5 :
شعاع اتمی
الکترون های لایه خارجی توسط الکترون های لایه داخلی از بار هسته تا حدودی حفاظت می شوند .
هرچقدر دوره بیشتر شود شعاع اتمی زیادتر می گردد
اما در یک دوره با افزایش عدد اتمی از چپ به راست، شعاع کوچکتر می شود.
(تعداد الکترون های لایه داخلی ثابت است و بار موثر هسته به تدریج زیاد می شود.)
تغییرات شعاع اتمی در عناصر واسطه
شعاع اتمی تدریجا کاهش ولی با نزدیک شدن به انتهای سری که لایه فرعی d در حال کامل شدن است ، افزایش می یابد.
کاهش شعاع اتمی در لانتانید ها را انقباض لانتانیدی گویند.
شعاع کوولانسی
همپوشانی اربیتال های الکترونی دو اتم پیوند یافته
شعاع کوالانسی : نصف فاصله هسته ی دو اتم یکسان در یک پیوند کوولانسی
اسلاید 6 :
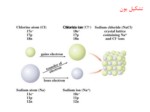
پيوند يوني
تركيب يوني كلريد سديم را در نظر ميگيريم. هنگامي كه فلز سديم و
گاز كلر با هم تماس مييابند بسرعت تركيب شده و كلريد سديم جامد
به دست ميآيد. سديم تمايل زيادي به از دست دادن الكترون و رسيدن
به آرايش اكتد (گاز بياثرNe ) دارد پس انرژي كمي صرف يون شدن
سديم ميشود.(انرژی یون شدن سدیم کم است)
اسلاید 7 :
از طرفي كلر تمايل زيادي به جذب الكترون و رسيدن به
آرايش گاز بياثر بعدي (Ar) را دارد، پس الكترون خواهي
زيادي دارد.
اسلاید 8 :
نتايج زير در پيوند يوني
1- يك پيوند يوني از انتقال كامل الكترون از فلز به غير فلز تشكيل ميشود و
در اثر اين انتقال فلز به يون مثبت و غير فلز به يون منفي تبديل ميشود.
2- تعداد كل الكترونهاي از دست دادة فلز برابر تعداد كل الكترونهاي دريافت
شده غير فلز است. (توازن بار)
3-معمولا یون های فلزی(نه همه) ارایش یک گاز بی اثر را دارند.
اسلاید 9 :
3- تركيبات يوني به غير از حالت گازي، متشكل از يك جفت يون تنها نيستند
به عبارتي در حالت جامد با آرايش منظم (حالت بلوري) يونها با بار مخالف
احاطه شدهاند.
4- واحد فرمولي تركيبات يوني= كمترين تعداد يونهايي كه با آرايش منظم دركنار هم قرار گرفتند و مجموعه از نظر الكتريكي خنثي است.
اسلاید 10 :
انرژی فرایند تشکیل بلور از یون های + و- انرژی شبکه بلوری یا انرژی شبکه گویند.
بعضی عناصر واسطه مثل آهن و قلع بسته به شرایط واکنش دو کاتیون تولید می کنند
Fe2+ , Fe3+ Sn2+, Sn4+
انرژی شبکه بلوری Fe3+ ازانرژی شبکه بلوری Fe2+ بیشتر است ولذا هر دو یون قابل تشکیل هستند
انرژی شبکه بلوری Sn4+ ازانرژی شبکه بلوری Sn2+ بیشتر است ولذا هر دو یون قابل تشکیل هستنددر اکسید سدیم نسبت کاتیون(Na+) به آنیون(O2-) 2:1
در سدیم کلرید نسبت کاتیون(Na+) به آنیون(Cl-) 1:1
در اکسید منیزیم (MgO) نسبت کاتیون(Mg2+) به آنیون(O2-) 1:1 است.